题目内容
有关下图装置的说法中正确的是( )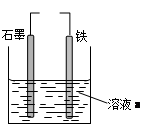
| A.若两电极直接连接,a是食盐水,则发生析氢腐蚀 |
| B.若两电极直接连接,则电子从铁流向石墨 |
| C.若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 |
| D.若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动 |
B
解析试题分析:若两电极直接连接,a是食盐水,则形成闭合回路,模拟钢铁的吸氧腐蚀,而不是析氢腐蚀,因为氯化钠是强酸强碱盐,不能水解,其溶液显中性,故A错;若两电极直接连接,形成的原电池中铁是负极,石墨是正极,则电子从铁流向石墨,故B正确;若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,形成电解池,铁作阴极,石墨作阳极,阳离子移向阴极,阴离子移向阳极,根据放电顺序可得,电解稀硫酸溶液实质是电解水,随着水的消耗,硫酸浓度增大,溶液酸性增强,pH减小,故C错;若铁接电源正极,石墨接电源负极,a是氯化铜溶液,则形成电解池,铁作阳极,石墨作阴极,阴离子移向阳极,向铁电极移动,故D错。
考点:考查原电池和电解原理,涉及钢铁的吸氧腐蚀和析氢腐蚀、原电池的构成条件、正负极的确定、外电路中电子流向、惰性电极电解稀硫酸后溶液pH的变化、电解池的阴阳极、内电路中阴阳离子的移动方向等。

一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液下列说法不正确的是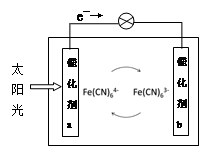
| A.K+移向催化剂b |
| B.催化剂a表面发生的化学反应:Fe(CN)64--e- = Fe(CN)63- |
| C.Fe(CN)63-在催化剂b表面被氧化 |
| D.电解池溶液中的Fe(CN)64-和Fe(CN)63-浓度基本保持不变 |
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备
HCOOH的原理示意图,下列说法不正确的是( ) 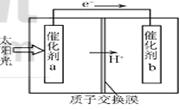
| A.该过程是将太阳能转化为化学能的过程 |
| B.催化剂a表面发生氧化反应,有O2产生 |
| C.催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2+ + 2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b用导线连接时,铁片上发生的反应为:Fe — 3e-= Fe3+ |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是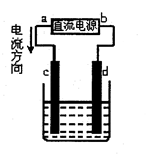
| A.a为电源正极 |
| B.d电极的反应为:2Cl-—2e-=Cl2↑ |
| C.电解过程中,c电极质量不断增加 |
| D.电解过程中,溶液中铜离子浓度逐渐减小 |
把锌片和铁片放在盛有食盐水和酚酞的混合溶液中(如图所示平面图),一段时间后,两个实验中,先观察到溶液变红的区域是
| A.I和III附近 |
| B.I和IV附近 |
| C.II和III附近 |
| D.II和IV附近 |
下列与装置有关的说法正确的是
| A.图a中,随着电解的进行溶液中H+的浓度越来越大 |
| B.图b中,Mg电极作电池的负极 |
| C.图c中,发生的反应为Co+Cd2+= Cd+Co2+ |
| D.图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀 |
下图是电解饱和NaCl溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是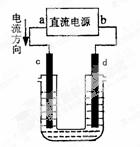
| A.a为阳极、b为阴极 | B.c为阴极、d为阳极 |
| C.电解过程中,d处加酚酞变红 | D.电解过程中,氯离子浓度不变 |
根据下图,下列判断中不正确的是( )
| A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下) |