题目内容
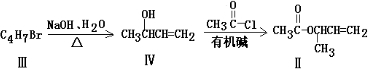
[2012·广东肇庆市一模](14分)I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
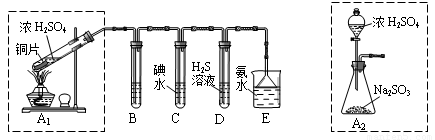
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;
C中反应的离子方程式为 。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是 (写两点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
|
实验操作 |
预期现象与结论 |
|
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
|
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 |
。 |
|
步骤3: 。 |
。 |
(14分)(1)品红溶液 SO2+I2+2H2O =SO42-+2 I-+4H+
(2)不用加热(或节约能源或药品);相对安全;易于控制反应进行;反应更充分(任何合理的两点均给分)
(3)NH3·H2O+SO2=NH4++HSO3-
(4)
|
实验操作 |
预期现象与结论 |
|
步骤2:滴入1滴(或少量)品红溶液,再滴入过量2mol/L盐酸,振荡 |
若品红褪色(或有气泡),则“吸收液”中存在 SO32-。 |
|
步骤3:用试管取适量滤液,向其中滴入过量的1mol/LBa(OH)2溶液 [或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡。 |
若出现白色沉淀(或品红溶液褪色,或有气泡,),则“吸收液”中存在 HSO3-。 |
【解析】(1)用碘水检验SO2的还原性,该反应的离子方程式为:SO2+I2+2H2O =SO42-+2 I-+4H+,用H2S检验SO2的氧化性,该反应的反应方程式为:2H2S+SO2=3S↓+2H2O,用品红溶液检验SO2的漂白性,故B中所盛试剂为品红溶液。
(2)用装置A2制取SO2的优点有:①反应不需要加热,比较安全;②用分液漏斗滴加反应物浓硫酸,易于控制反应进行;③滴加的浓硫酸能够与Na2SO3充分反应。
(3)过量的SO2与氨水反应生成亚硫酸氢铵,反应的离子方程式为:NH3·H2O+SO2=NH4++HSO3-。
(4)若“吸收液”中存在SO32-,则步骤2中的固体为BaSO3,向该固体中滴入1滴(或少量)品红溶液,再滴入过量2mol/L盐酸,振荡,固体溶解,品红溶液褪色且有气泡产生。
若“吸收液”中存在HSO3-,则步骤2中的滤液中含有HSO3-,取适量的滤液于试管中,滴加过量的l mol/LBa(OH)2溶液,会产生白色沉淀;或取适量的滤液于试管中,滴加1滴(或少量)品红溶液,再滴入2~3滴(或过量)的2mol/L盐酸,振荡,品红溶液褪色且有气泡产生。

[2012·广东肇庆市一模](14分)I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答: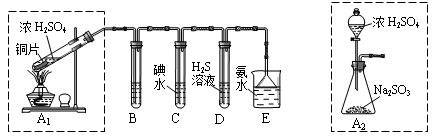
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;
C中反应的离子方程式为 。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是 (写两点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | 。 |
| 步骤3: 。 | 。 |