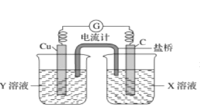
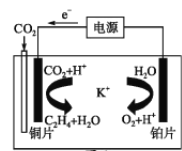
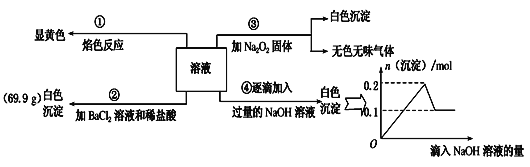
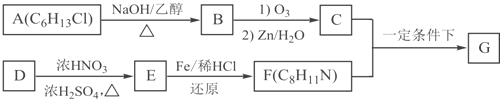
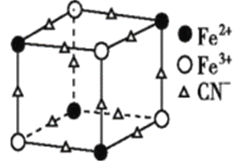
题目内容
【题目】8.34g FeSO47H2O 样品在隔绝空气条件下受热脱水 过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是( )
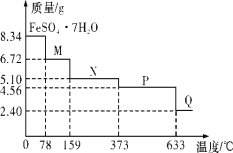
A.温度为 80℃时固体物质 M 的化学式为 FeSO45H2O
B.温度为 200℃时固体物质N 化学式为 FeSO43H2O
C.在隔绝空气条件下由N 到 P 的化学方程式为FeSO4![]() FeO+SO3↑
FeO+SO3↑
D.取 380℃ 时所得的样品 P,隔绝空气加热至 650℃, 得到的固体物质 Q 的化学式为 Fe2O3,同时有两种无色气体生成
【答案】D
【解析】
8.34g FeSO47H2O样品物质的量=![]() =0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO47H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=
=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO47H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=![]() =0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答该题。
=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答该题。
A.温度为80℃时,固体质量为6.72g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=6.72g-4.56g=2.16g,n(H2O)=![]() =0.12mol,则n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则化学式为FeSO44H2O,故A错误;
=0.12mol,则n(H2O):n(FeSO4)=0.12mol:0.03mol=4:1,则化学式为FeSO44H2O,故A错误;
B.温度为200℃时,固体质量为5.10g,其中m(FeSO4)=0.03mol×152g/mol=4.56g,m(H2O)=5.10g-4.56g=0.54g,n(H2O)=![]() =0.03mol,则n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则化学式为FeSO4H2O,故B错误;
=0.03mol,则n(H2O):n(FeSO4)=0.03mol:0.03mol=1:1,则化学式为FeSO4H2O,故B错误;
C.由B选项和上述分析可知,N点对应物质为FeSO4H2O,P点对应物质为FeSO4,因此在隔绝空气条件下由N 到 P 的化学方程式为:FeSO4H2O![]() FeSO4+H2O,故C错误;
FeSO4+H2O,故C错误;
D.由上述分析可知,Q点对应物质为Fe2O3,P点为FeSO4,P点为4.56g FeSO4,其物质的量为0.03mol,P→Q的过程中,Fe元素化合价升高,则S元素化合价会下降生成SO2,根据原子守恒可知,生成0.015mol Fe2O3,失去电子为0.03mol,若S元素全部生成SO2,则需得到0.06mol电子,得失电子不守恒,因此还有一部分SO3生成,因此最终气体为SO2和SO3的混合气体,故D正确;
故答案为:D。