题目内容
已知:2Fe+3Cl2 2FeCl3,下列说法正确的是(设nA为阿伏加德罗常数的数值)
2FeCl3,下列说法正确的是(设nA为阿伏加德罗常数的数值)
A.氯气是氧化剂,FeCl3是还原剂
B.常温下,与56g Fe反应断裂1.5 nA个Cl—Cl键 (相对原子质量:Fe-56)
C.1 L 0.1 mol•L-1 FeCl3溶液中含有0.1 nA个Fe3+
D.常温常压下,22.4 L 的Cl2和足量Fe反应转移3 nA个电子
【答案】
B
【解析】
试题分析:观察化学方程式,氯元素由0价升为—1价,铁元素由0价降为+3价,铁单质是还原剂,氯气是氧化剂,氯化铁是氧化产物和还原产物,故A选项错误;由于n=m/M,则n(Fe)=1mol,则2Fe+3Cl2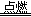 2FeCl3中氯气与铁的系数之比等于物质的量之比,则n(Cl2)=1.5mol,由于氯气的结构式为Cl—Cl,则1.5molCl2分子中含有1.5molCl—Cl键,故B选项正确;由于n=c•V,则氯化铁的物质的量为0.1mol,由于氯化铁是强酸弱碱盐,铁离子少部分水解,则溶液中铁离子小于0.1mol,故C选项错误;由于n=V/Vm,常温常压下气体摩尔体积大于22.4L/mol,则n(Cl2)<1mol,由于2Fe+3Cl2
2FeCl3中氯气与铁的系数之比等于物质的量之比,则n(Cl2)=1.5mol,由于氯气的结构式为Cl—Cl,则1.5molCl2分子中含有1.5molCl—Cl键,故B选项正确;由于n=c•V,则氯化铁的物质的量为0.1mol,由于氯化铁是强酸弱碱盐,铁离子少部分水解,则溶液中铁离子小于0.1mol,故C选项错误;由于n=V/Vm,常温常压下气体摩尔体积大于22.4L/mol,则n(Cl2)<1mol,由于2Fe+3Cl2 2FeCl3~6e—中转移电子与氯气的系数之比等于物质的量之比,则该反应中转移电子小于3mol,故D选项错误。
2FeCl3~6e—中转移电子与氯气的系数之比等于物质的量之比,则该反应中转移电子小于3mol,故D选项错误。
考点:考查阿伏加德罗常数,涉及体积、气体摩尔体积、物质的量、氧化还原反应、物质的量在化学或电离方程式计算中的应用、物质的量浓度、强电解质、物质的组成、水的离子积、溶液的pH、电离方程式等。

练习册系列答案
相关题目
 已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.
已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去. (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0


