题目内容
在化工分析中常用到滴定度这个概念。滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g·mL-1。现有一不溶于水的氧化亚铜样品,该样品能溶于用硫酸酸化了的硫酸铁溶液,所发生反应的化学方程式为(未配平):
Cu2O+Fe2(SO4)3+H2SO4 CuSO4+FeSO4+H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):
CuSO4+FeSO4+H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):
KMnO4+H2SO4+FeSO4 Fe2(SO4)3+MnSO4+K2SO4+H2O
Fe2(SO4)3+MnSO4+K2SO4+H2O
若每升滴定剂溶液中含有0.400 mol KMnO4,求该KMnO4溶液对Cu2O的滴定度。
每毫升KMnO4溶液中含KMnO4的物质的量为0.400
mol× =4.00×10-4 mol
=4.00×10-4 mol
2KMnO4+8H2SO4+10FeSO4====5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
Cu2O+Fe2(SO4)3+H2SO4====2CuSO4+2FeSO4+H2O
由以上两方程知
2KMnO4—10FeSO4—5Cu2O
2 mol 5×144 g
4.00×10-4 mol m(Cu2O)
m(Cu2O)=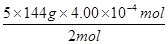 ="0.144" g
="0.144" g
即KMnO4溶液对Cu2O的滴定度为0.144 g·mL-1。
【解析】
试题分析:由题意每毫升滴定剂溶液中含KMnO4的物质的量为0.400 mol× =4.00×10-4 mol。
=4.00×10-4 mol。
2KMnO4+8H2SO4+10FeSO4====5Fe2(SO4)3+2MnSO4+K2SO4+8H2O ①
Cu2O+Fe2(SO4)3+H2SO4====2CuSO4+2FeSO4+H2O ②
由①②得2KMnO4—10FeSO4—5Cu2O
由以上关系式可求Cu2O的质量
即2KMnO4—10FeSO4—5Cu2O
2 mol 5×144 g
4.00×10-4 mol m(Cu2O)
m(Cu2O)=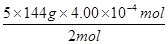 ="0.144" g
="0.144" g
即KMnO4溶液对Cu2O的滴定度为0.144 g·mL-1。
考点:考查滴定度的有关计算
点评:该题是中等难度的试题,试题综合性强,贴近高考,有助于激发学生的学习兴趣。该题在注重对基础知识考查对同时,更注重考查学生分析问题、灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范的答题能力,提高学生的应试能力。

 CuSO4 + FeSO4 + H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):
CuSO4 + FeSO4 + H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平): CuSO4 +
FeSO4 + H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):
CuSO4 +
FeSO4 + H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):