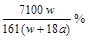题目内容
25 ℃时,将两个铜电极插入一定量的Na2SO4饱和液中进行电解。通电一段时间后,在阴极逸出a mol气体,同时有W g Na2SO4·10H2O晶体析出。若温度保持不变,剩余溶液中溶质的质量分数为( )A.![]() % B.
% B.![]() %
%
C. ![]() % D.
% D.![]() %
%
解析:用铜电极电解Na2SO4溶液,两极发生的反应为:
阴极:2H++2e-====H2↑
阳极:Cu-2e-====Cu2+
且阴极H2放出,产生的OH-与阳极产生Cu2+结合产生Cu(OH)2沉淀。电解的总反应式为:Cu+2H2O![]() H2↑+Cu(OH)2↓。阴极放出a mol H2,水被电解了2a mol,析出的W g Na2SO4·10H2O中含Na2SO4:Wg×
H2↑+Cu(OH)2↓。阴极放出a mol H2,水被电解了2a mol,析出的W g Na2SO4·10H2O中含Na2SO4:Wg×![]() ,析出的Na2SO4·10H2O和被电解了的H2O组合在一起就是饱和Na2SO4溶液,所以:
,析出的Na2SO4·10H2O和被电解了的H2O组合在一起就是饱和Na2SO4溶液,所以:

答案:D

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
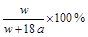 B.
B.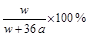
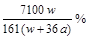 D.
D.