题目内容
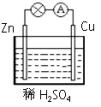
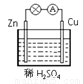
 如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )
如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )分析:在用锌片、铜片和稀硫酸组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,铜片作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答:解:A.该装置中,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑,故A错误;
B.该装置中,锌作负极,锌失电子发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故B错误;
C.锌易失电子而作负极,则铜作正极,故C正确;
D.电子从锌沿导线流向铜片,故D错误;
故选C.
B.该装置中,锌作负极,锌失电子发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故B错误;
C.锌易失电子而作负极,则铜作正极,故C正确;
D.电子从锌沿导线流向铜片,故D错误;
故选C.
点评:本题考查了原电池原理,难度不大,明确正负极的判断、电子的流向、电极反应式即可解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
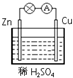 如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )
如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )