题目内容
【题目】Ⅰ.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
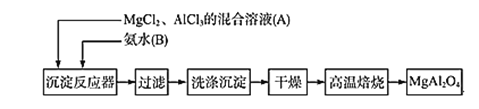
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净的方法是__________________________________________,高温焙烧时,用于盛放固体的仪器名称是________________。
Ⅱ.无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
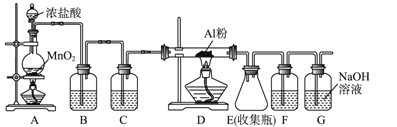
(3)其中装置A用来制备氯气,写出其化学反应方程式______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的离子方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
【答案】AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl 取最后一次洗涤液少量于试管中,滴加少量硝酸酸化的硝酸银,若没有白色沉淀产生,则证明沉淀已被洗涤干净 坩埚 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去混在氯气中的氯化氢 浓硫酸 Cl2+2OH— = Cl—+ClO—+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
MnCl2+Cl2↑+2H2O 除去混在氯气中的氯化氢 浓硫酸 Cl2+2OH— = Cl—+ClO—+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
【解析】
本题是制备实验方案的设计。
(1)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵;
(2)判断流程中沉淀是否洗净的方法是取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液,若生成白色沉淀,则说明洗涤液中还含有Cl-,沉淀没有洗涤干净;若没有沉淀生成,则说明沉淀已经洗涤干净。
(3)根据实验装置图可知,该实验中用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢、水等杂质,先用饱和食盐水除氯化氢,再用浓硫酸干燥,氯气与铝反应制得氯化铝,反应的尾气中有氯气用氢氧化钠吸收,为防止氯化铝与氢氧化钠溶液中的水蒸气反应,所以在收集装置和尾气吸收装置之间加一干燥装置F,据此分析解答。
Ⅰ.(1)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵,反应方程式为:AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl。本小题答案为:AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl。
(2)判断流程中沉淀是否洗净的方法是取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液,若生成白色沉淀,则说明洗涤液中还含有Cl-,沉淀没有洗涤干净;若没有沉淀生成,则说明沉淀已经洗涤干净。本小题答案为:取最后一次洗涤液少量于试管中,滴加少量硝酸酸化的硝酸银,若没有白色沉淀产生,则证明沉淀已被洗涤干净。
Ⅱ.(3)A中用浓盐酸与二氧化锰反应生成氯气,化学反应方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。本小题答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。本小题答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(4)氯气中混有氯化氢,氯化氢气体极易溶于水,装置B中盛放饱和NaCl溶液是用饱和NaCl溶液除去混在氯气中的氯化氢。本小题答案为:除去混在氯气中的氯化氢。
(5)为防止氯化铝与氢氧化钠溶液中的水蒸气反应,所以在收集装置和尾气吸收装置之间加一盛有浓硫酸的干燥装置F,G中用氢氧化钠处理未反应完的氯气,离子方程式为:Cl2+2OH-= Cl-+ClO-+H2O。本小题答案为:浓硫酸;Cl2+2OH- = Cl-+ClO-+H2O。
(6)A中还有盐酸与二氧化锰反应得到的氯化锰,硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀,故测定反应残余液中盐酸的浓度此法不可行。本小题答案为:不可行;硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案