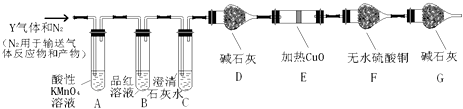
题目内容
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出).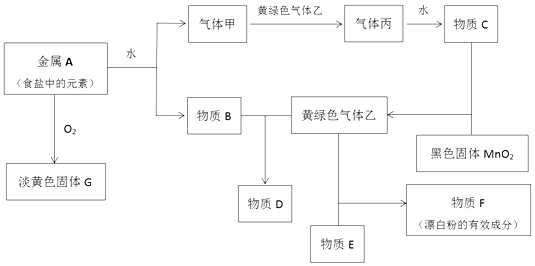
请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
MnO2 做剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是mol
(2)写出下列反应的离子方程式:
①金属A和水
②物质B和气体乙
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因
(4)用化学方程式解释F长期放置在空气中失效的原因:
(5)红热细铁丝能在气体乙剧烈燃烧,现象是将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在
之间.向氢氧化铁胶体中滴入过量稀硫酸,现象是 .
【答案】
(1)氧化,2
(2)2Na+2H2O=2Na++2OH﹣+H2↑,2OH﹣+Cl2=Cl﹣+ClO﹣+H2O
(3)2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
(4)Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO ![]() 2HCl+O2↑
2HCl+O2↑
(5)产生棕红色的烟,1﹣100nm,先产生红褐色沉淀最后溶解为黄色溶液
【解析】解:(1)反应中Mn元素化合价降低,被还原,则二氧化锰为氧化剂,如果反应产生的气体在标况下体积为2.24L,则生成1mol氯气,反应中Cl元素化合价由﹣1价升高到0价,则有2molHCl被氧化,
所以答案是:氧化; 2;
(2)①钠和水反应生成氢氧化钠和氢气,方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
所以答案是:2Na+2H2O=2Na++2OH﹣+H2↑;
②氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水,方程式为2OH﹣+Cl2=Cl﹣+ClO﹣+H2O,
所以答案是:2OH﹣+Cl2=Cl﹣+ClO﹣+H2O;
(3)过氧化钠可与水、二氧化碳反应生成氧气,可用作供氧剂,方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,
所以答案是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑;
(4)漂白粉的主要成分为CaCl2、Ca(ClO)2,长期露置空气中时次氯酸钙与水、二氧化碳反应生成碳酸钙和HClO,HClO易分解,从而变质,发生变质时发生的反应为Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO ![]() 2HCl+O2↑,
2HCl+O2↑,
所以答案是:Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO ![]() 2HCl+O2↑;
2HCl+O2↑;
(5)铁在氯气中燃烧生成氯化铁,可观察到产生棕红色的烟,胶体粒子直径介于 1﹣100nm,在氢氧化铁胶体中加入盐酸,胶体发生聚沉,然后氢氧化铁溶液盐酸,可观察到先产生红褐色沉淀最后溶解为黄色溶液,
所以答案是:产生棕红色的烟;1﹣100nm; 先产生红褐色沉淀最后溶解为黄色溶液.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案