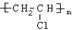题目内容
| A.加足量的NaOH溶液,看是否有蓝色沉淀生成 |
| B.加少量还原铁粉,看是否有Cu析出 |
| C.加KSCN溶液,看溶液是否显红色 |
| D.用纸上层析法分离后,再用浓氨水熏.看滤纸上是否出现深蓝色 |
B.加少量还原铁粉,如只发生2Fe3++Cu=2Fe2++Cu2+,没有铜析出,不能检验,故B错误;
C.加KSCN溶液,不能检验CuCl2,故C错误;
D.用纸上层析法分离出CuCl2,CuCl2与氨水发生络合反应,滤纸呈蓝色,可检验CuCl2,故D正确.
故选D.

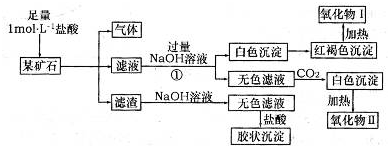
(16分)某研究小组取足量形状、质量均相同的铝片,分别与浓度均为6 mol?L-1的等体积的盐酸、氢氧化钠溶液充分反应后,取出剩余的铝片洗净、干燥、称量。
(1)上述反应剩余铝片的质量,前者________后者(填“大于”或“小于”或“等于”)。
(2)观察铝片与盐酸反应后的溶液较浑浊,且试管底部有少量黑色固体。
查资料已知:
①铝与盐酸反应,因反应过快而变成粉末分散到溶液中,形成黑色固体
②电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,氧化铝中往往还含有微量的氧化铁和二氧化硅杂质。写出在电解池中生成的铝与杂质二氧化硅反应的化学方程式: ________。
(3)为探究(2)中黑色固体的成分,提出合理假设。
假设1:黑色固体是Al和Fe
假设2:黑色固体是Al和Si
假设3:黑色固体是Al和_______________
(4)设计实验方案,基于假设3进行实验,验证黑色固体含有Al之外的其它成分。
限选实验试剂:蒸馏水、6mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、6mol·L-1氨水、0.01mol·L-1KMnO4溶液、新制氯水、20%KSCN溶液。
| 实验步骤 | 预期实验现象和结论 |
| 步骤1:将反应所得浊液过滤、洗涤,取少量固体于试管中,加入足量的6mol·L-1 H2SO4溶液,充分振荡,静置。 | ___________________________________, 证明黑色固体含有Si |
| 步骤2: | |
滤去不溶物(不考虑可溶物的损失),配成250mL溶液,取出25.00mL溶液,按下列操作进行实验:

在上述操作中,需要用到的玻璃定量仪器有________________________________;
计算黑色固体中Al的质量分数为__________________(相对原子质量:Al-27 Fe-56 H-1 O-16)。
(16分)某研究小组取足量形状、质量均相同的铝片,分别与浓度均为6 mol•L-1的等体积的盐酸、氢氧化钠溶液充分反应后,取出剩余的铝片洗净、干燥、称量。
(1)上述反应剩余铝片的质量,前者________后者(填“大于”或“小于”或“等于”)。
(2)观察铝片与盐酸反应后的溶液较浑浊,且试管底部有少量黑色固体。
查资料已知:
①铝与盐酸反应,因反应过快而变成粉末分散到溶液中,形成黑色固体
②电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,氧化铝中往往还含有微量的氧化铁和二氧化硅杂质。写出在电解池中生成的铝与杂质二氧化硅反应的化学方程式: ________。
(3)为探究(2)中黑色固体的成分,提出合理假设。
假设1:黑色固体是Al和Fe
假设2:黑色固体是Al和Si
假设3:黑色固体是Al和_______________
(4)设计实验方案,基于假设3进行实验,验证黑色固体含有Al之外的其它成分。
限选实验试剂:蒸馏水、6mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、6mol·L-1氨水、0.01mol·L-1KMnO4溶液、新制氯水、20%KSCN溶液。
|
实验步骤 |
预期实验现象和结论 |
|
步骤1:将反应所得浊液过滤、洗涤,取少量固体于试管中,加入足量的6mol·L-1 H2SO4溶液,充分振荡,静置。 |
___________________________________, 证明黑色固体含有Si |
|
步骤2:
|
|
(5)已知硅与NaOH溶液反应与铝相似。取m1g黑色固体加足量NaOH溶液充分溶解,
滤去不溶物(不考虑可溶物的损失),配成250mL溶液,取出25.00mL溶液,按下列操作进行实验:
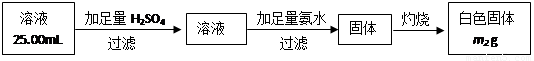
在上述操作中,需要用到的玻璃定量仪器有________________________________;
计算黑色固体中Al的质量分数为__________________(相对原子质量:Al-27 Fe-56 H-1 O-16)。