题目内容
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH (g)△H1=-116kJ?mol-1
(1)下列措施中有利于提高反应速率的是 (双选,填字母).
A.移去部分CH3OH B.减小压强 C.通入CO D.加入催化剂
(2)已知:CO(g)+
O2(g)=CO2(g)△H2=-283kJ?mol-1H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1
写出1mol甲醇燃烧生成CO2和水蒸气的热化学方程式 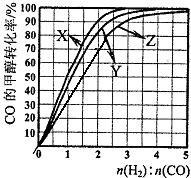
(3)为研究合成气最合适的起始组成比,在1L容器中,分别在230℃、250℃和270℃下,改变CO和 H2的起始组成比(设起始时CO的物质的量为1mol ),结果如图:
①230℃的实验结果所对应的曲线是 (填字母).
②从图中可以得出的结论是 .(写一条)
③在270℃时,当CO的转化率为50%时,计算反应CO(g)+2H2(g)?CH3OH (g)的平衡常数(写出计算过程,保留2位小数) .
(1)下列措施中有利于提高反应速率的是
A.移去部分CH3OH B.减小压强 C.通入CO D.加入催化剂
(2)已知:CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
写出1mol甲醇燃烧生成CO2和水蒸气的热化学方程式

(3)为研究合成气最合适的起始组成比,在1L容器中,分别在230℃、250℃和270℃下,改变CO和 H2的起始组成比(设起始时CO的物质的量为1mol ),结果如图:
①230℃的实验结果所对应的曲线是
②从图中可以得出的结论是
③在270℃时,当CO的转化率为50%时,计算反应CO(g)+2H2(g)?CH3OH (g)的平衡常数(写出计算过程,保留2位小数)
分析:(1)提高反应速率可增大浓度、压强、温度或加入催化剂;
(2)利用盖斯定律计算反应热;
(3)①正反应放热,则升高温度CO的转化率降低;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大;
③计算出平衡时各物质的浓度,结合K=
计算.
(2)利用盖斯定律计算反应热;
(3)①正反应放热,则升高温度CO的转化率降低;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大;
③计算出平衡时各物质的浓度,结合K=
| c(CH3OH) |
| c(CO)?c2(H2) |
解答:解:(1)提高反应速率可增大浓度、压强、温度或加入催化剂,则C、D正确,而移去部分CH3OH、减小压强可减小反应速率,故答案为:CD;
(2))①根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ?mol-1,
②CO(g)+
O2(g)═CO2(g)△H2=-283kJ?mol-1,
③H2(g)+
O2(g)═H2O(g)△H3=-242kJ?mol-1,
根据盖斯定律:①-②-③×2得:CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-651kJ?mol-1,
故答案是:CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-651kJ?mol-1;
(3)①根据该反应为放热反应,温度越高CO的转化率越小,所以曲线X为230℃,故答案为:X;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大,故答案为:温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大;
③由图象可知当270℃、CO的转化率为50%时,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
=
=4.00,
故答案为:4.00.
(2))①根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ?mol-1,
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
根据盖斯定律:①-②-③×2得:CH3OH(g)+
| 3 |
| 2 |
故答案是:CH3OH(g)+
| 3 |
| 2 |
(3)①根据该反应为放热反应,温度越高CO的转化率越小,所以曲线X为230℃,故答案为:X;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大,故答案为:温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大;
③由图象可知当270℃、CO的转化率为50%时,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.52 |
故答案为:4.00.
点评:本题考查化学平衡问题,侧重于学生的分析和计算能力的考查,为高考常见题型和高频考点,注意把握图象曲线的变化趋势,把握平衡常数的计算方法,难度中等.

练习册系列答案
相关题目
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知:



1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为 。
和水蒸气的热化学方程式为 。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是 (双选)。
CH3OH(g)反应速率的是 (双选)。
| A.分离出CH3OH | B.升高温度 | C.减小压强 | D.加入合适的催化剂 |

①曲线X对应的温度是 。
②从图中可以得出的结论有 (任写一条)。
(4)若往反应的容积中加入1.5molH2和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g)
 CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程) 
 CH3OH(g)
CH3OH(g)
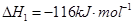
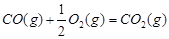
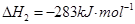
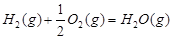
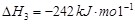
 和水蒸气的热化学方程式为
。
和水蒸气的热化学方程式为
。