题目内容
(6分)在第三周期元 素中,除稀有气体元素外:
素中,除稀有气体元素外:
⑴原子半径最小的元素是 ;(填元素符号)
⑵金属性最强的元素是 ;(填元素符号)
⑶最高价氧化物对应水化物酸性最强的是 ,(用化学式回答,下同):
⑷最不稳定的气态氢化物是 ;
⑸最高价氧化物对应水化物碱性最强的是 ;
⑹氧化物中具有两性的是 。
 素中,除稀有气体元素外:
素中,除稀有气体元素外:⑴原子半径最小的元素是 ;(填元素符号)
⑵金属性最强的元素是 ;(填元素符号)
⑶最高价氧化物对应水化物酸性最强的是 ,(用化学式回答,下同):
⑷最不稳定的气态氢化物是 ;
⑸最高价氧化物对应水化物碱性最强的是 ;
⑹氧化物中具有两性的是 。
Cl Na HClO4 SiH4 NaOH Al2O3
略

练习册系列答案
相关题目
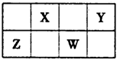
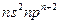
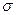 键和
键和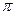 键的个数比为 。在T—Y、T—Z两种共价键中,键长较长的是 。
键的个数比为 。在T—Y、T—Z两种共价键中,键长较长的是 。 g)
g)
 水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液