题目内容
一定条件下将8mol H2和4molCO充入0.5L的密闭容器中,发生如下反应:2H2(g)+CO(g) CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:
CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:(1)用H2表示的化学反应速率.
(2)如果此时将反应所得到的混合物充分燃烧,至少需要标准状况下的氧气多少升?
【答案】分析:(1)根据v=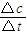 计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
(2)根据原子守恒可知,可以看做H2与CO按2:1混合,所以反应混合物完全燃烧所需氧气,为8molH2和4molCO燃烧所需氧气.
解答:解:(1)6s内以CH3OH表示化学反应速率为v(CH3OH)=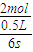 =
= mol/(L?s),
mol/(L?s),
由速率之比等于化学计量数之比,所以v(H2)=2v(CH3OH)=2× mol/(L?s)=
mol/(L?s)= mol/(L?s),
mol/(L?s),
答:用H2表示的化学反应速率为 mol/(L?s);
mol/(L?s);
(2)2H2~O2 2CO~O2
8mol 4mol 4mol 2mol
所需氧气体积为(4mol+2mol)×22.4L/mol=13.44L.
答:至少需要标准状况下的氧气13.44L.
点评:本题考查反应速率定量表示方法、化学平衡计算,难度不大,(2)按三段式计算出6s时混合物各组分的物质的量,比较繁琐,本解法利用守恒转化思想,化繁为简.
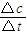 计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);(2)根据原子守恒可知,可以看做H2与CO按2:1混合,所以反应混合物完全燃烧所需氧气,为8molH2和4molCO燃烧所需氧气.
解答:解:(1)6s内以CH3OH表示化学反应速率为v(CH3OH)=
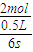 =
= mol/(L?s),
mol/(L?s),由速率之比等于化学计量数之比,所以v(H2)=2v(CH3OH)=2×
 mol/(L?s)=
mol/(L?s)= mol/(L?s),
mol/(L?s),答:用H2表示的化学反应速率为
 mol/(L?s);
mol/(L?s);(2)2H2~O2 2CO~O2
8mol 4mol 4mol 2mol
所需氧气体积为(4mol+2mol)×22.4L/mol=13.44L.
答:至少需要标准状况下的氧气13.44L.
点评:本题考查反应速率定量表示方法、化学平衡计算,难度不大,(2)按三段式计算出6s时混合物各组分的物质的量,比较繁琐,本解法利用守恒转化思想,化繁为简.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
 CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:
CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:


 (2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为 。
(2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为 。