题目内容
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
B
试题分析:该反应中氮元素的化合价由0价降到-3价,被还原,氮气作氧化剂。碳元素由0价升高到+2价,被氧化、碳作还原剂,A、C错;B、正确;D、摩尔质量要带单位。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中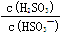 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,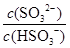 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。
 。则下列判断错误的是.
。则下列判断错误的是.