题目内容
甲、乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10 g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热。试管冷却后,乙称得甲留下的反应混合物的质量为4.04 g,将它继续加热,直到氯酸钾全部分解,得到氧气672 mL(标准状况)。求甲实验时氯酸钾分解的百分率。
50%
从题给已知条件可知,解题时应从乙得到的氧气的量入手。
设乙分解KClO3的质量为x,甲分解KClO3的质量为y。
2KClO3 2KCl + 3O2↑
2KCl + 3O2↑
2 mol×122.5 2 mol×74.5 3 mol×22.4
g·mol-1 g·mol-1 L·mol-1
x 0.672 L
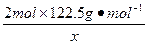 =
=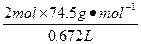
解得:x="2.45" g
在4.04 g混合物中:m(KCl)="4.04" g-0.10 g-2.45 g="1.49" g。即甲分解KClO3时得到的KCl质量为1.49 g,由此可计算y:
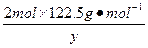 =
=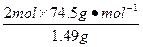
解得:y="2.45" g。
故甲实验时KClO3分解的百分率为:
 ×100%=50%。
×100%=50%。
本题若从物质的量入手计算会更简便。
解:设乙分解KClO3的物质的量为x,甲分解KClO3的物质的量为y。
2KClO3 2KCl + 3O2↑
2KCl + 3O2↑
2 mol 2 mol 3 mol
X
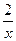 =
=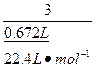 , 解得:x="0.02" mol
, 解得:x="0.02" mol
在4.04 g混合物中:m(KCl)="4.04" g-0.10 g-(0.02 mol×122.5 g·mol-1)="1.49" g。即甲分解KClO3得到的KCl的质量为1.49 g,由此计算y:
2KClO3 2KCl+3O2↑
2KCl+3O2↑
2 mol 2 mol
y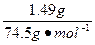
解得:y="0.02" mol
故甲实验时KClO3分解的百分率为:
 ×100%=50%。
×100%=50%。
设乙分解KClO3的质量为x,甲分解KClO3的质量为y。
2KClO3
 2KCl + 3O2↑
2KCl + 3O2↑2 mol×122.5 2 mol×74.5 3 mol×22.4
g·mol-1 g·mol-1 L·mol-1
x 0.672 L
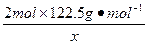 =
=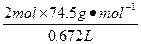
解得:x="2.45" g
在4.04 g混合物中:m(KCl)="4.04" g-0.10 g-2.45 g="1.49" g。即甲分解KClO3时得到的KCl质量为1.49 g,由此可计算y:
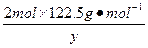 =
=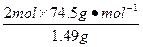
解得:y="2.45" g。
故甲实验时KClO3分解的百分率为:
 ×100%=50%。
×100%=50%。本题若从物质的量入手计算会更简便。
解:设乙分解KClO3的物质的量为x,甲分解KClO3的物质的量为y。
2KClO3
 2KCl + 3O2↑
2KCl + 3O2↑2 mol 2 mol 3 mol
X

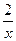 =
=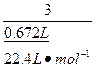 , 解得:x="0.02" mol
, 解得:x="0.02" mol在4.04 g混合物中:m(KCl)="4.04" g-0.10 g-(0.02 mol×122.5 g·mol-1)="1.49" g。即甲分解KClO3得到的KCl的质量为1.49 g,由此计算y:
2KClO3
 2KCl+3O2↑
2KCl+3O2↑2 mol 2 mol
y
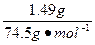
解得:y="0.02" mol
故甲实验时KClO3分解的百分率为:
 ×100%=50%。
×100%=50%。
练习册系列答案
相关题目