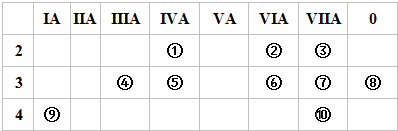
题目内容
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 同温同压下,C18O与N2的密度相同 | |
| B. | 同体积同密度的C2H4与C3H6含有的分子数相同 | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为$\frac{m{N}_{A}}{2}$ |
分析 A、同温同压下,气体的密度之比等于相对分子质量之比;
B、C2H4与C3H6的摩尔质量不同;
C、标况下,苯为液体;
D、根据Na2O2与H2O的反应可知:每增重2g,转移1mol电子.
解答 解:A、同温同压下,气体的密度之比等于相对分子质量之比,C18O的相对分子质量为30,N2的相对分子质量均为28,故同温同压下,两气体的密度不相同,故A错误;
B、同体积铜密度的C2H4与C3H6的质量相同,但由于两者的摩尔质量不同,根据n=$\frac{m}{M}$可知,两者的物质的量不同,则所含的分子个数N=n•NA不同,故B错误;
C、标况下,苯为液体,故不能根据气体摩尔体积来计算物质的量,故C错误;
D、根据Na2O2与H2O的反应:2Na2O2+2H2O=4NaOH+O2↑可知:此反应增重4g,转移2mol电子,即增重2g时,转移NA个电子,故当每增重mg,转移电子的数目为$\frac{m{N}_{A}}{2}$,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.氢元素与其它元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | 一个D2O分子所含的中子数为8 | |
| B. | NH3的结构式为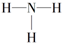 | |
| C. | HCl的电子式为H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 热稳定性:HCl>HF |
19.下列原子或离子的基态电子排布式正确的是( )
| A. | Ni2+:[Ar]3d8 | B. | Cu:[Ar]3d94s2 | C. | S2-:[Ne]2s23p6 | D. | Si:[Ar]3s23p2 |
16.下列有关化学键的说法中,不正确的是( )
| A. | 氢键不是化学键,而是一种特殊的分子间作用力 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 化学反应过程中,反应物分子的化学键断裂消耗能量,生成物分子中化学键形成放出能量 | |
| D. | 氯化钠中存在离子键,所以食盐水是离子化合物 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2 L CH3COOH中含有的C-H数目为1.5NA | |
| B. | 1.0 L 0.1 mol•L-1的NH4Cl溶液中NH4+的个数小于0.1NA | |
| C. | 电解AgNO3溶液得到22.4 L O2,理论上需要转移4NA个电子 | |
| D. | 25℃时,2.0 L pH=12的Na2CO3溶液中含有OH-的数目为0.02NA |
20.在可逆反应中,改变下列条件一定能加快反应速率的是( )
①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大表面积.
①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大表面积.
| A. | 全部 | B. | ①② | C. | ①②③ | D. | ①②③④ |
 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为
 .
.
 ;
;