题目内容
【题目】
铬及其化合物广泛应用于生活、生产。酒精测量仪的原理是2K2Cr2O7+8H2SO4+3CH3CH2OH=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,K2Cr2O7遇到CH3CH2OH颜色由橙红色变成绿色。
(1)基态铬原子的价电子排布式为__________。金属离子在水溶液中颜色与未成对电子有关,Cr3+在水溶液中呈绿色。1个基态Cr3+有__________个未成对电子。
(2)1 molCH3COOH 分子中含__________molπ键。CrCl3晶体很稳定,其熔点为83℃,CrCl3晶体熔化时破坏的作用力类型是__________。Cr2(SO4)3中阴离子的立体构型为__________。
(3)乙醇被氧化的中间产物为乙醛(CH3CHO),在乙醇、乙酸和乙醛中,乙醛的沸点最低,其主要原因是________________。乙醛分子中碳原子的杂化类型是__________。
(4)Cr(OH)3是两性氢氧化物,与烧碱溶液反应生成Cr(OH)4-,画出该阴离子的结构图示:__________。
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。
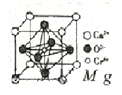
①该晶体的化学式为__________。
②已知该晶体的密度为ρg.cw-3,NA代表阿伏加德罗常数的数值,晶体的摩尔质量为Mg·mol-1。则该晶胞参数(a)为__________pm。
③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中Ca2+和La3+的物质的量之比为![]() (x<0.1),则该晶体中+3价铬与+4价铬的物质的量之比为__________ 。
(x<0.1),则该晶体中+3价铬与+4价铬的物质的量之比为__________ 。
【答案】 3d54s1 3 1 分子间作用力 正四面体 乙醇和乙酸分子都能形成分子间氢键,乙醛分子间只存在范德华力 sp2、sp3  CaCrO3 【答题空10】
CaCrO3 【答题空10】![]() ×1010
×1010 ![]()
【解析】试题分析:(1)铬原子核外有24个电子,有6个价电子。
(2)双键中有1个是π键。CrCl3晶体很稳定,其熔点为83℃,根据熔点低,可知,CrCl3晶体为分子晶体。根据价键理论判断Cr2(SO4)3中阴离子的立体构型。
(3)根据氢键分析在乙醇、乙酸和乙醛中,乙醛的沸点最低的原因。根据价电子对数分析碳原子的杂化类型。
(4)Cr(OH)4-中Cr3+与OH-形成4个配位键。
(5)①根据均摊原则计算晶体的化学式。
②根据![]() 计算晶胞边长。
计算晶胞边长。
③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中Ca2+和La3+的物质的量之比为![]() (x<0.1),根据化合价代数和等于0计算晶体中+3价铬与+4价铬的物质的量之比。
(x<0.1),根据化合价代数和等于0计算晶体中+3价铬与+4价铬的物质的量之比。
解析:(1)铬原子核外有24个电子,有6个价电子,价电子排布式为3d54s1 。
(2)双键中有1个是π键,1个CH3COOH分子含有1个C=O双键,1 molCH3COOH 分子中含1molπ键。CrCl3晶体很稳定,其熔点为83℃,__________。Cr2(SO4)3中阴离子的立体构型为。CrCl3晶体很稳定,其熔点为83℃,根据熔点低,可知,CrCl3晶体为分子晶体,CrCl3晶体熔化时破坏的作用力类型是分子间作用力。SO42-中S原子的价电子对数=![]() ,无孤对电子,SO42-立体构型正四面体。
,无孤对电子,SO42-立体构型正四面体。
(3)乙醇、乙酸含有氢键,乙醛分子间无氢键,所以乙醛的沸点最低。乙醛分子中甲基碳原子的价电子对数![]() 、醛基中碳原子的价电子对数=
、醛基中碳原子的价电子对数=![]() ,C原子杂化类型是sp3、sp2。
,C原子杂化类型是sp3、sp2。
(4)Cr(OH)4-中Cr3+与OH-形成4个配位键,Cr(OH)4-的结构图示 。
。
(5)①根据均摊原则,Ca2+数为![]() =1,O2-数为
=1,O2-数为![]() 、Cr4+数为1,所以晶体的化学式为CaCrO3。
、Cr4+数为1,所以晶体的化学式为CaCrO3。
②1个晶胞的体积为![]() ,1mol晶胞的体积为
,1mol晶胞的体积为![]() 。1mol晶胞的质量为Mg,则
。1mol晶胞的质量为Mg,则![]() ,a=
,a=![]() ×1010 ;
×1010 ;
③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中Ca2+和La3+的物质的量之比为![]() (x<0.1),则化式为Ca(1-x) LaxCrO3 ,根据化合价代数和等于0,Cr的化合价,4-x,晶体中+3价铬物质的量为a, +4价铬的物质的量为1-a,3a+4(1-a)=4-x,a=x,所以晶体中+3价铬与+4价铬的物质的量之比为
(x<0.1),则化式为Ca(1-x) LaxCrO3 ,根据化合价代数和等于0,Cr的化合价,4-x,晶体中+3价铬物质的量为a, +4价铬的物质的量为1-a,3a+4(1-a)=4-x,a=x,所以晶体中+3价铬与+4价铬的物质的量之比为![]() 。
。

 名校课堂系列答案
名校课堂系列答案