题目内容
【题目】砷(As)是第四周期第V A族元素,用化学用语回答问题:
(1)砷的最高价氧化物对应的水化物化学式是 _________,气态氢化物的稳定性ASH3________(填写“大于”或“小于”)NH3。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。雄黄和雌黄的转换关系如图1所示:
①气体物质a是 _____________(填化学式)。
②第I步反应的离子方程式是_________________________________。

(3)Na2HAsO3溶液呈碱性,原因是_______________(用离子方程式表示),该溶液中c(H2AsO3-)______ c(AsO33-) (填“>”、“<”或“=”)。
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O![]() AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
【答案】 H3AsO4 小于 SO2 2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4 HAsO32-+H2O![]() H2AsO3-+OH- > AsO43-+2e- +H2O= AsO33-+2OH- I2 + 2e- =2I-
H2AsO3-+OH- > AsO43-+2e- +H2O= AsO33-+2OH- I2 + 2e- =2I-
【解析】 (1) 砷(As)是第四周期第V A族元素,砷的最高价氧化物对应的水化物化学式为H3AsO4,同一主族,从上到下,元素的非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,稳定性ASH3小于NH3,故答案为:H3AsO4;小于;
(2) ①Ⅱ中,As4S4反应后生成As2O3,根据化合价升降守恒,硫元素的化合价需要升高,因此气体物质a为二氧化硫,故答案为: SO2;
②Ⅰ中Sn的化合价升高,As的化合价降低,所以As2S3在反应中得电子作氧化剂,反应的离子方程式为2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4,故答案为:2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4;
(3) Na2HAsO3溶液呈碱性,是因为Na2HAsO3属于强碱弱酸盐,存在HAsO32-+H2O![]() H2AsO3-+OH-,Na2HAsO3溶液呈碱性,说明水解程度大于电离沉淀,因此溶液中c(H2AsO3-)>c(AsO33-) ,故答案为:HAsO32-+H2O
H2AsO3-+OH-,Na2HAsO3溶液呈碱性,说明水解程度大于电离沉淀,因此溶液中c(H2AsO3-)>c(AsO33-) ,故答案为:HAsO32-+H2O![]() H2AsO3-+OH-;>;
H2AsO3-+OH-;>;
(4) P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极, P中Pt极为正极,发生还原反应,反应式为I2 + 2e- =2I-,故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;I2 + 2e- =2I-。

【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成,并以液态储存。

(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:_______
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
实验项目 | 装置Ⅰ | 装置Ⅱ | |
制备的气体 | 烧瓶中 | 分液漏斗中 | |
a .制备纯净干燥的Cl2 | MnO2 | _______ | _______ |
b .制备纯净干燥的NO | Cu | _______ | _______ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
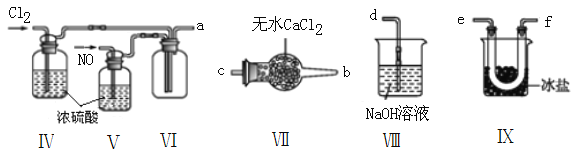
①装置连接顺序为a→____________________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________________。
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_________________________。
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为___________________。
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11


