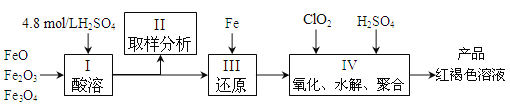
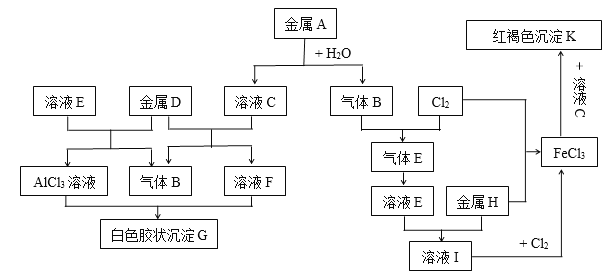
��Ŀ����
����Ŀ��������ͭ���Ǹ�������ѧ�н�Ϊ���ӵ����ʣ������Ҫ��ش����¸��⣺
��1��������ͭ�������������У����ڴ�������� ��
��2�������Ļ�ѧʽ�� �����ھ�ˮ����;�������˽���� ���ʡ�
��3��ͭ�̵���Ҫ�ɷ��Ǽ�ʽ̼��ͭCu2(OH)2CO3������CuԪ�صĻ��ϼ��� ����֪����ͭ���ڱ�¶�ڿ����л���H2O��CO2��O2��Ӧ���ɼ�ʽ̼��ͭ����Ӧ�Ļ�ѧ����ʽΪ��2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3��������1mol��ԭ��ʱ��ת�Ƶĵ������� mol������˫���ŷ���ʾ�˷�Ӧ����ת�Ƶ������2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3
���𰸡�(1) ����
(2)KAl(SO4)2��12H2O �۳�
(3)+2 2
��������
�����������1����������һ��������ɵģ����ڴ����ͭ�̵���Ҫ�ɷ��Ǽ�ʽ̼��ͭ����ͭ�̲��Ǵ����
��2�������Ļ�ѧʽ��KAl(SO4)2��12H2O����������ˮ���������Al3��ˮ�����������������壬������������������ˮ�е�����������˽���۳������ʴﵽ��ˮ��Ŀ�ġ�
��3��ͭ�̵���Ҫ�ɷ��Ǽ�ʽ̼��ͭCu2(OH)2CO3�������������ϼ۵Ĵ����͵����㣬CuԪ�صĻ��ϼ���+2�ۣ��ڷ�Ӧ2Cu + O2 + H2O + CO2 =Cu2(OH)2CO3�У�ͭԪ�صĻ��ϼ���0�����ߵ�+2�ۣ����Ե�����1mol��ԭ��ʱ��ת�Ƶĵ�������2mol��˫���ŷ���ʾ�˷�Ӧ����ת�Ƶ�������£�
 ��
��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�