题目内容
【题目】将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C+H2O(g) ![]() CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2 . C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1;
②H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
③CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式: .
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量(填“多”或“少”).
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”.乙同学根据盖斯定律作出了下列循环图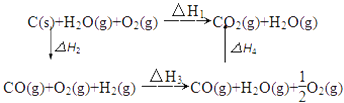
请你写出△H1、△H2、△H3、△H4之间存在的关系式 .
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同.”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是 .
【答案】
(1)C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
(2)多,△H1=△H2+△H3+△H4,乙,甲同学忽略了煤转化为水煤气要吸收热量
【解析】解:(1)①C(石墨,s)+O2(g)=CO2(g)△H=﹣393.5 kJ/mol,
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJ/mol,
O2(g)=CO2(g)△H=﹣283.0 kJ/mol,
③H2(g)+ ![]() O2(g)=H2O(g)△H=﹣242.0kJ/mol,
O2(g)=H2O(g)△H=﹣242.0kJ/mol,
根据盖斯定律,①﹣②﹣③得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,
所以答案是:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
(2)①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1;
②H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1;
③CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1;
比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量多,
化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
△H1、△H2、△H3、△H4之间存在的关系式为:△H1=△H2+△H3+△H4;
依据盖斯定律可知,将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同,乙正确;煤转化为水煤气要吸收热量,煤炭燃烧时加少量水,结合盖斯定律可知,煤炭燃烧放出相同的热量;
所以答案是:多;△H1=△H2+△H3+△H4;乙;甲同学忽略了煤转化为水煤气要吸收热量.