题目内容
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
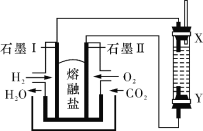
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
【答案】Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)Al2O3+2OH![]() 2AlO2+H2O
2AlO2+H2O
(3)NH4Cl+H2O![]() NH3·H2O+HCl,MgO+2 HCl
NH3·H2O+HCl,MgO+2 HCl![]() MgCl2+H2O
MgCl2+H2O
Ⅱ.(1)S、Fe Fe3S4
(2)制印刷电路板
(3)![]() Fe3S4+6H+
Fe3S4+6H+![]() 3H2S↑+3Fe2++S
3H2S↑+3Fe2++S
(4)H2SO3+I2+H2O![]() H2SO4+2HI
H2SO4+2HI
取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42,过滤后取滤液,滴加H2O2溶液,若产生白色沉淀,则有H2SO3。
【解析】
试题Ⅰ.(1)2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气,故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气,故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
(2)氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、碱溶于,加入氢氧化钠溶于溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氯化铵溶液中铵根离子水解溶液显酸性,氧化镁溶于水解生成的酸,反应的化学方程式为:MgO+2NH4Cl+H2O=MgCl2+2NH3H2O,故答案为:MgO+2NH4Cl+H2O=MgCl2+2NH3H2O;
Ⅱ.C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=![]() =0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=
=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=![]() =0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4。
=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4。
(1)由以上分析可知,A组成元素为Fe、S,为Fe3S4,故答案为:Fe、S;Fe3S4;
(2)铁离子具有强氧化性,可氧化铜,常用于刻饰铜线路板,故答案为:刻饰铜线路板;
(3)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,电子式为![]() ,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,故答案为:
,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,故答案为:![]() ;Fe3S4+6H+=3Fe2++S+3H2S↑;
;Fe3S4+6H+=3Fe2++S+3H2S↑;
(4)F→G反应的化学方程式为H2SO3+I2+H2O=H2SO4+2HI,溶液G中的主要微粒(不考虑H2O,H+,K+,I-) 为SO42-和H2SO3,可先检验SO42-,后检验有H2SO3,具体操作为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3.故答案为:H2SO3+I2+H2O=H2SO4+2HI;取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3。

【题目】已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:(1)通过表格中的数值可以推断:K1随温度的升高而____________,(填增大,减小,不变),所以反应①是____________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) ![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___(填写字母序号,下同)。
A.增大压强(压缩容器体积)
B.体积不变时充入稀有气体
C.升高温度
D.使用合适的催化剂
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件可能是_____________ 、____________。
②图乙中t2时刻发生改变的条件可能是__________。
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强 E.减小压强 F.充入CO2 G.分离出部分CO