题目内容
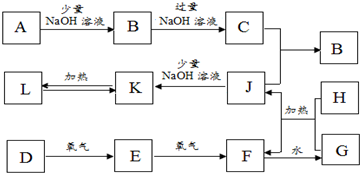
如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.反应①常被应用于野外焊接钢轨,A为日常生活中常见的金属单质,G为黄绿色气体,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液.

请回答下列问题:
(1)H的化学式为
(2)反应②在工业上通常称之为
(3)写出反应③的离子方程式
(4)写出反应②的化学方程式

请回答下列问题:
(1)H的化学式为
NaOH
NaOH
.(2)反应②在工业上通常称之为
氯碱
氯碱
工业.(3)写出反应③的离子方程式
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(4)写出反应②的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
分析:反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al
2Fe+Al2O3,则A为Al,B为Fe2O3,G为黄绿色气体,应为Cl2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2,结合物质的性质解答该题.
| ||
解答:解:反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al
2Fe+Al2O3,则A为Al,B为Fe2O3,G为黄绿色气体,应为Cl2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2,
(1)由以上分析可知H为NaOH,故答案为:NaOH;
(2)反应②为电解饱和食盐水的反应,工业上称为氯碱工业,故答案为:氯碱;
(3)反应③为Al2O3和NaOH的反应,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,反应的方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
| ||
(1)由以上分析可知H为NaOH,故答案为:NaOH;
(2)反应②为电解饱和食盐水的反应,工业上称为氯碱工业,故答案为:氯碱;
(3)反应③为Al2O3和NaOH的反应,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,反应的方程式为2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
点评:本题考查无机物的推断,题目难度较大,本题注意把握物质的反应特征、物质的本身特性以及工业反应为突破口进行推断,明确物质的种类为解答该题的关键.

练习册系列答案
相关题目