题目内容
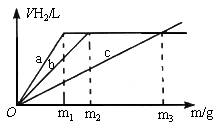
将36.5g HCl气体用适量水吸收制得盐酸,若往此溶液中分别投入适量的Na,Mg,Al各mg,相同条件下产生H2的体积与反应的金属的质量存在下图所示关系:
(1)计算回答,m1,m2和m3的值各是多少?
(2)曲线a,b,c分别表示哪一种金属与盐酸的反应?
(3)若使三种金属产生的VH2的关系为Na>Mg=Al,则m值的范围应为多少?
(4)能否使产生的VH2关系为Mg>Na>Al?

答案:
解析:
解析:
(1)由图知加入的Na,Mg,Al刚好与36.5gHCl完会反应,根据化学方程式计算可得: 2Na+2HCl=2NaCl+H2↑ 2´23 2´36.5 m(Na) 36.5 m(Na)=23g Mg+2HCl=2NaCl+H2↑ 24 73 m(Mg) 36.5 m(Mg)=12g 2Al+6HCl=2AlCl3+3H2↑ 54 6´36.5 m(Al) 36.5 m(Al)=9g (2)由图知m1<m2<m3 所以与m1对应a为Al,与m2对应b为Mg,与m3对应c为Na。 (3)当m为23g时产生VH2都相同,要使产生VH2的关系为Na>Mg=Al则m>23g 因为多余的Na可与水反应产生H2,而Mg,Al一般不反应。 (4)不能;从图分析知,当Mg,Al的m相同时,产生的VH2的关系一定是为Al>Mg或Al=Mg不可能存在Al<Mg。所以以上关系不成立。
|

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目