题目内容
已知0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,则此溶液中H+的物质的量浓度是
- A.1 mol/L
- B.0.5 mol/L
- C.0.6 mol/L
- D.0.1 mol/L
A
分析:根据电荷守恒溶液中n(H+)=n(Cl-)+2n(SO42-),再根据c= 计算氢离子的浓度.
计算氢离子的浓度.
解答:0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,
根据电荷守恒溶液中n(H+)=n(Cl-)+2n(SO42-)=0.1mol+2×0.2mol=0.5mol,
故溶液中氢离子的浓度为: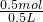 =1mol/L,
=1mol/L,
故选A.
点评:本题考查物质的量浓度的有关计算,难度不大,注意电解质混合溶液中利用电荷守恒进行的计算.
分析:根据电荷守恒溶液中n(H+)=n(Cl-)+2n(SO42-),再根据c=
 计算氢离子的浓度.
计算氢离子的浓度.解答:0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,
根据电荷守恒溶液中n(H+)=n(Cl-)+2n(SO42-)=0.1mol+2×0.2mol=0.5mol,
故溶液中氢离子的浓度为:
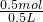 =1mol/L,
=1mol/L,故选A.
点评:本题考查物质的量浓度的有关计算,难度不大,注意电解质混合溶液中利用电荷守恒进行的计算.

练习册系列答案
相关题目
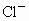 和0.2mol
和0.2mol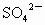 ,则此溶液中
,则此溶液中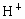 的物质的量浓度
的物质的量浓度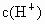 为
为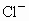 和0.2mol
和0.2mol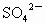 ,则此溶液中
,则此溶液中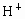 的物质的量浓度
的物质的量浓度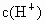 为
为