题目内容
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)Y元素在元素周期表中的位置___________________________
(2)Y2X对应水化物的电子式_______________________________
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因_________________________
(4)Z元素的最简单氢化物与X单质可形成一种原电池,如果以氢氧化钠溶液为电解质,则该原电池负极电极反应方程式为:________________________________________
(5)X、Y两种元素还可以形成另外一种化合物,试用电子式表示该物质的形成过程:_______________,该化合物与1mol ZX2完全反应,则反应中电子转移的数目为___________________________
【答案】 第三周期 第ⅠA族 ![]() 水分子间存在氢键 CH4-8e-+10OH-=CO32-+7H2O
水分子间存在氢键 CH4-8e-+10OH-=CO32-+7H2O 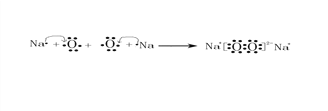 NA
NA
【解析】Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,设最外层电子数为a,则2/3(2+a)=a,解得a=4,故Z为C元素;则X、Y原子质子数之和为25-6=19,设X原子的质子数为x,Y原子的质子数为y,则x+y=19,而Z与Y的原子序数之和比X的原子序数的2倍还多1,则6+y=2x+1,联立方程解得x=8,y=11,即X为O元素,Y为Na,则
(1)由上述分析可知,Y为Na元素,在元素周期表中的位置是:第三周期IA族;(2)Na2O对应水化物是氢氧化钠,属于离子化合物,电子式为![]() ;(3)水分子间存在氢键,因此氧元素的氢化物比同主族的氢化物的熔沸点明显偏高;(4)Z元素的最简单氢化物甲烷与X单质可形成一种原电池,其中甲烷发生失去电子的氧化反应,则甲烷在负极通入,因此如果以氢氧化钠溶液为电解质,则该原电池负极电极反应方程式为CH4-8e-+10OH-=CO32-+7H2O;(5)X、Y两种元素还可以形成另外一种化合物是离子化合物过氧化钠,电子式表示该物质的形成过程为
;(3)水分子间存在氢键,因此氧元素的氢化物比同主族的氢化物的熔沸点明显偏高;(4)Z元素的最简单氢化物甲烷与X单质可形成一种原电池,其中甲烷发生失去电子的氧化反应,则甲烷在负极通入,因此如果以氢氧化钠溶液为电解质,则该原电池负极电极反应方程式为CH4-8e-+10OH-=CO32-+7H2O;(5)X、Y两种元素还可以形成另外一种化合物是离子化合物过氧化钠,电子式表示该物质的形成过程为![]() 。该化合物与1mol CO2完全反应,反应中过氧化钠既是氧化剂,也是还原剂,电子转移的数目为NA。
。该化合物与1mol CO2完全反应,反应中过氧化钠既是氧化剂,也是还原剂,电子转移的数目为NA。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案