题目内容
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行惰性电极电解饱和氯化钠溶液实验。回答下列问题:
(1)甲烷燃料电池正极的电极反应为_________、负极的电极反应为_________ 。
(2)如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。电解氯化钠溶液的离子反应方程式为_________。
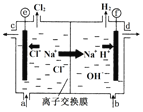
(3)精制饱和食盐水从图中_____位置补充,浓氢氧化钠溶液从图中______位置流出。(选填“a”、“b”、“c” 或“d”)
(4)若甲烷通入量为1L(标准状况),且反应完全,则最多能产生的氯气体积为______L(标准状况)
【答案】 2O2+4H2O+8e-=8OH- CH4+10OH--8e-=CO32-+7H2O 2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑ a d 4L
2OH-+Cl2↑+H2↑ a d 4L
【解析】试题分析:(1)在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O,故答案为:2O2+4H2O+8e-=8OH-;CH4+10OH--8e-=CO32-+7H2O;
(2)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2H2O+2Cl-![]() Cl2↑+2OH-+H2↑,故答案为:2H2O+2Cl-
Cl2↑+2OH-+H2↑,故答案为:2H2O+2Cl-![]() Cl2↑+2OH-+H2↑;
Cl2↑+2OH-+H2↑;
(3)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,故答案为:a,d;
(4)根据CH4-8e-+10OH-═CO32-+7H2O,若甲烷通入量为lL(标准状况),且反应完全,转移的电子的物质的量为![]() ×8=
×8=![]() mol,根据2H2O+2Cl-
mol,根据2H2O+2Cl-![]() Cl2↑+2OH-+H2↑,最多能产生标准状况下的氯气体积为
Cl2↑+2OH-+H2↑,最多能产生标准状况下的氯气体积为![]() mol ×
mol ×![]() ×22.4L/mol=4L,故答案为:4。
×22.4L/mol=4L,故答案为:4。

【题目】(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式____________________________________。
(2)己知反应N2+3H2![]() 2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
化学键 | H-H | N-H | N≡N |
键能kJ/mol | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
己知:C(s,石墨)+O2(g)=CO2(g) △Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) △H3=-2599kJ/mol
裉推盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:__________。