题目内容
下列有关气体制取的反应中,其原理不属于氧化还原反应的是
- A.用稀硫酸与锌粒反应制取 H2
- B.用稀盐酸与石灰石反应制取CO2
- C.用浓盐酸与二氧化锰加热制取Cl2
- D.用高锰酸钾加热分解制取 O2
B
凡是有元素化合价升降的反应都是氧化还原反应,所以选项A、C、D都是氧化还原反应,选项B是复分解反应,不是氧化还原反应,答案选B。
凡是有元素化合价升降的反应都是氧化还原反应,所以选项A、C、D都是氧化还原反应,选项B是复分解反应,不是氧化还原反应,答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
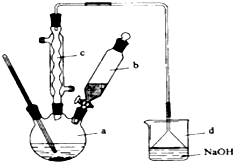
 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图及有关数据如下:按下列合成步骤回答问题:
| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体.继续滴加至液溴滴完.装置d的作用是______;制取溴苯的化学方程式______.该反应的催化剂为______.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:______.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)取反应后烧杯中的溶液2ml加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成,______(能或不能)证明苯与液溴反生了取代反应,为什么?______.
有关元素X、Y、Z、D、E的信息如下:
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 .
(2)比较Y与Z的氢化物的稳定性>(用化学式表示) .
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出QkJ的热量.写出该反应的热化学方程式 .
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 .
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过amol电子时,阴阳两极共产生气体 L(标准状况).
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 .
(2)比较Y与Z的氢化物的稳定性>(用化学式表示) .
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出QkJ的热量.写出该反应的热化学方程式 .
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 .
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过amol电子时,阴阳两极共产生气体 L(标准状况).
 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图及有关数据如下:按下列合成步骤回答问题: