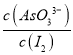题目内容
【题目】砷及其化合物广泛用于制造半导体材料以及用于医疗、农药等。回答下列问题:
(1)砷与氮同主族,原子序数比氮大26,则砷在元素周期表中的位置是____________;砷化氢的电子式为______________________。
(2)H3AsO3又叫路易斯酸,是一种弱酸,发生酸式电离是通过和水中的氢氧根离子结合实现的,则第一步电离方程式为____________________________________________;若常温时H3AsO3的第一步电离常数Ka1=1.0×10-9,则常温下,0.1mol·L-1的H3AsO3溶液的pH为_______________。
(3)利用可逆的氧化还原反应AsO![]() +2I-+2H+
+2I-+2H+![]() AsO
AsO![]() +I2+H2O可以设计为原电池,起始时在甲、乙两池中分别加入图示药品并连接装置。
+I2+H2O可以设计为原电池,起始时在甲、乙两池中分别加入图示药品并连接装置。
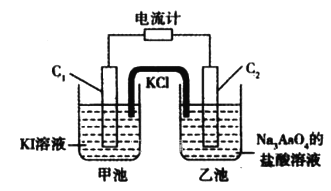
①起始时,甲池石墨棒C1上发生的电极反应为_____________________。
②一段时间后指针不发生偏转。欲使指针偏转方向与起始时相反,应采取的可行措施是_______________________________________________________________(举一例)。
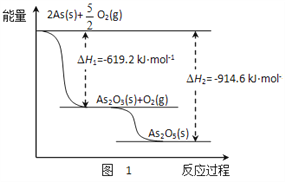
【答案】 第四周期VA族 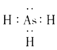 H3AsO3+H2O
H3AsO3+H2O![]() [As(OH)4]-+H+ 5 2I--2e-=I2 在甲池中加入(Na3AsO3)固体或在乙池中加入碱
[As(OH)4]-+H+ 5 2I--2e-=I2 在甲池中加入(Na3AsO3)固体或在乙池中加入碱
【解析】(1)因N处于第二周期,As与N原子序数相差26,则多两个电子层,故在第四周期第VA族;AsH3电子式与NH3类似,为: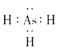 ;(2)H3AsO3是一种弱酸,信息可知其第一步电离的方程式为:H3AsO3+H2O
;(2)H3AsO3是一种弱酸,信息可知其第一步电离的方程式为:H3AsO3+H2O![]() [As(OH)4]-+H+;根据电离方程式和电离平衡常数,求得c(H+)=1.0×10-5mol/L,即PH=5;(3) ①起始时正向进行,C1为负极,发生的电极反应为2I--2e-=I2;②若要逆向进行,依据方程式As
[As(OH)4]-+H+;根据电离方程式和电离平衡常数,求得c(H+)=1.0×10-5mol/L,即PH=5;(3) ①起始时正向进行,C1为负极,发生的电极反应为2I--2e-=I2;②若要逆向进行,依据方程式As![]() +2I-+2H+
+2I-+2H+![]() As
As![]() +I2+H2O,应增大生成物浓度或减小反应物的浓度,在甲池中加入(Na3AsO3)固体或在乙池中加入碱以消耗氢离子,使氢离子浓度降低。
+I2+H2O,应增大生成物浓度或减小反应物的浓度,在甲池中加入(Na3AsO3)固体或在乙池中加入碱以消耗氢离子,使氢离子浓度降低。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案