题目内容
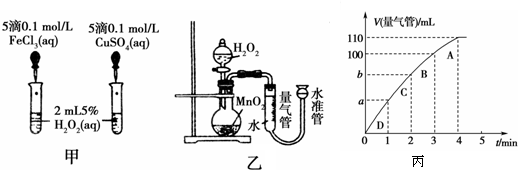
催化剂在生产和科技领域中起着重大作用.为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题.
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论 (填“合理”或“不合理”),理由是 .
(2)同学Y利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如丙图所示.
①b (填“<”、“>”或“=”)90mL,原因是 .
②同学Y除了探究MnO2对H2O2分解速率的影响情况,还可得出 对H2O2分解速率的影响情况.
(3)催化剂能加快反应速率,是因为它能改变反应的路径,使发生反应所需的活化能 (填“升高”“降低”“不变”).
【答案】分析:(1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)①根据图象斜率判断反应速率快慢;
②反应过程催化剂没变,但反应物的浓度降低,反应速率减小;
(3)根据催化剂与活化能的关系解答.
解答:解:(1)催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,其结论不合理,故答案为:不合理;阴离子种类不同;
(2)①图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL,
故答案为:<;由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL;
②在加入催化剂的条件下随着反应物浓度的降低,反应速率减小,故答案为:反应物浓度;
(3)催化剂加快化学反应速率是降低了反应的活化能,故答案为:降低.
点评:本题考查了催化剂的作用,题目难度中等,解答须理清化学反应速率与催化剂间的关系以及速率与图象间的关系.
(2)①根据图象斜率判断反应速率快慢;
②反应过程催化剂没变,但反应物的浓度降低,反应速率减小;
(3)根据催化剂与活化能的关系解答.
解答:解:(1)催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,其结论不合理,故答案为:不合理;阴离子种类不同;
(2)①图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL,
故答案为:<;由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL;
②在加入催化剂的条件下随着反应物浓度的降低,反应速率减小,故答案为:反应物浓度;
(3)催化剂加快化学反应速率是降低了反应的活化能,故答案为:降低.
点评:本题考查了催化剂的作用,题目难度中等,解答须理清化学反应速率与催化剂间的关系以及速率与图象间的关系.

练习册系列答案
相关题目