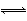
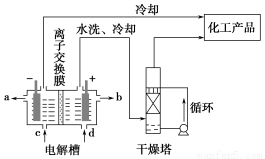
题目内容
已知25 ℃时KW=10-14,如果100 ℃时KW=5.5×10-13,这说明( )
A.100 ℃时水的电离程度较小
B.前者c(H+)较后者大
C.水的电离过程是一个吸热过程
D.100 ℃时0.1 mol·L-1 DCl的重水溶液中水的电离程度一定是室温时电离程度的10倍
C
【解析】由题意知,随水溶液温度的升高,KW也随之增大。即c(H+)·c(OH-)较大。c(H+)·c(OH-)较大,说明H2O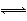 H++OH-向右进行的程度大,由此可知水的电离是吸热的。所以A、B两项错误,C项正确;当改用重水作溶剂时,由于重水的电离程度与普通水的电离程度不一定相同(事实上不同),所以室温时重水的离子积c(D+)·c(OD-)不一定等于1×10-14,也不能将普通水在100 ℃时的离子积常数应用于重水溶液,尽管DCl是强酸,在重水溶液中能够完全电离,题目告诉的浓度可以求出溶液中的c(D+),但因不知道两种温度条件下的重水离子积常数,所以无法得出c(OD-),也就是说无法知道两种温度条件下重水分子本身的电离程度,所以D项错误。
H++OH-向右进行的程度大,由此可知水的电离是吸热的。所以A、B两项错误,C项正确;当改用重水作溶剂时,由于重水的电离程度与普通水的电离程度不一定相同(事实上不同),所以室温时重水的离子积c(D+)·c(OD-)不一定等于1×10-14,也不能将普通水在100 ℃时的离子积常数应用于重水溶液,尽管DCl是强酸,在重水溶液中能够完全电离,题目告诉的浓度可以求出溶液中的c(D+),但因不知道两种温度条件下的重水离子积常数,所以无法得出c(OD-),也就是说无法知道两种温度条件下重水分子本身的电离程度,所以D项错误。

练习册系列答案
相关题目