题目内容
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式___________________________________________。
(2)已知:Se+2H2SO4(浓)―→2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O―→Se+2SO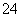 +4H+,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
+4H+,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
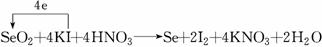
(3)回收得到的SeO2的含量,可以通过下面的方法测定: ①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3―→Na2S4O6+2NaI。配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
mL,所测定的样品中SeO2的质量分数为________。
解析:利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1∶1,即二者计量系数比为1∶1)可得方程式。利用氧化性:氧化剂>氧化产物,结合题中方程式可知氧化性:H2SO4(浓)>SeO2>SO 2。在反应①中I-失去电子,+4价Se得到电子被还原为单质Se。利用前面配平的方程式可得关系式:SeO2~2I2~4Na2S2O3,故样品中SeO2的质量分数为:
2。在反应①中I-失去电子,+4价Se得到电子被还原为单质Se。利用前面配平的方程式可得关系式:SeO2~2I2~4Na2S2O3,故样品中SeO2的质量分数为:
[111 g·mol-1×(0.200 0 mol/L×0.025 L)/4]/0.150 0 g=0.925。
答案:(1)Se+2HNO3(浓)―→H2SeO3+NO↑+NO2↑ (2)H2SO4(浓)>SeO2>SO2
(3) 
(4)0.925

下列可用来区别SO2和CO2气体的是( )
①澄清的石灰水②氢硫酸③氯水④酸性高锰酸钾⑤氯化钡⑥品红溶液
| A.①④⑤⑥ | B.②③④⑤ | C.①②③⑥ | D.②③④⑥ |
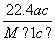 L B.
L B.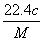 L
L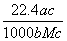 L D.
L D.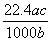 L
L
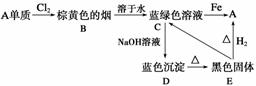
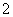
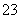 、SO
、SO