题目内容
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。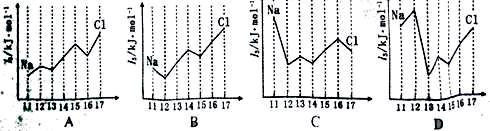
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH
 CH4↑+X(已配平)
CH4↑+X(已配平)①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。

(8分)(1)①离子 (1分)②Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高(2分)
(2)①3 (1分)②自由电子(1分)(3)极性键或σ键;(1分)<(1分)(4)D(1分)
(2)①3 (1分)②自由电子(1分)(3)极性键或σ键;(1分)<(1分)(4)D(1分)
试题分析:(1)①根据原子守恒可知,X应该是碳酸钠,属于离子晶体。
②氧化镁和氧化钙都是离子晶体,由于Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高。
(2)①根据基态Cr3+离子的核外电子排布可知,含有的未成对电子数有3个。
②K是金属,得到是靠自由电子,所以该导电的粒子是自由电子。
(3)甲烷是分子晶体,由于硅烷(SiH4)的结构与甲烷相似,所以SiH4分子中共价键的类型是极性键。氢元素被氧化,这说明在SiH4分子中氢元素的化合价是-1价,由此可判断电负性是Si<H。
(4)镁失去2个电子后,就已经达到稳定结构,所以镁的第三电离能最大,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,综合性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
 2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
2NH3(g) △H<0达到平衡的标志是__________________________(填编号)