题目内容
(6分)一定条件下,在密闭容器内将N2和H2以体积比为1∶3混合,当反应达平衡时,混合气中氨占25%(体积比),若混合前有10mol N2,求平衡后N2、H2、NH3的物质的量及N2的转化率。
6 18 8 40%
试题分析:设消耗N2物质的量为x。
N2 + 3H2
 2NH3
2NH3始(mol)10 30
平(mol)10-x 30-3x 2x
由氨气的体积分数得2x/(10-x+30-3x+2x)=0.25得x=4,所以平衡时氮气、氢气、氨气的物质的量分别为6mol、18mol、8mol,氮气的转化率为0.4。
点评:化学平衡计算的方法:列出起始、变化、平衡时各物质的量。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。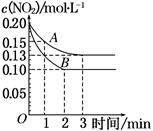
 2Z(g)。此反应达到平衡的标志是 ( )
2Z(g)。此反应达到平衡的标志是 ( ) H2(g) + CO(g), ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
H2(g) + CO(g), ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1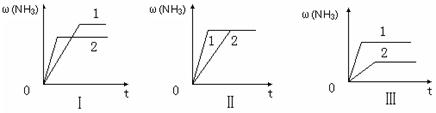
 CO2(aq) ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是
CO2(aq) ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是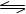
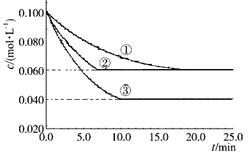
 C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是