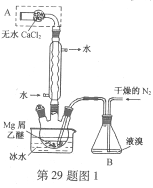
题目内容
【题目】【四川省泸州市2017届高三三诊考试理综】
以某种软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)为主要原料生产KMnO4的一种流程图如下:

已知:Mn(OH)2极易被空气氧化;Fe(OH)3、Al(OH)3的溶度积常数依次为4.0×10-38、1.3×10-33。
(1)滤渣A的化学式是_________;溶液B中的主要阴离子有______________。
(2)为避免引入杂质,②步调节pH加入的物质是____________;调节pH除杂过程中,后析出的
沉淀是________________。
(3)浓硫酸与MnO2反应也能生成Mn2+,其化学方程式是___________________。
(4)K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,则③步原料应保证_______________。
④步溶解水应煮沸的目的是_____________________。
(5)⑤步的阳极电极反应式是____________;该法电解时要产生污染,其原因是________________。
【答案】SiO2 SO42-、Cl- MnCO3或MnO Al(OH)3 2H2SO4(浓)+2MnO2=2MnSO4+ 2H2O+ O2↑ KOH过量 排除溶解的CO2 MnO42- -e-=MnO4- 电解时会生成氯气
【解析】(1) 软锰矿(主要成分MnO2,同时含有FeCO3、Al2O3、SiO2等)中加入稀硫酸,只有二氧化硅不溶,滤渣A的主要成分为二氧化硅;滤液中加入次氯酸钠,将亚铁离子氧化为铁离子,本身被含有为氯离子,溶液B中的主要阴离子有SO42-、Cl-,故答案为:SO42-、Cl-;
(2)溶液B中含有的阳离子为Mn2+、Fe3+、Al3+,②步的目的是调节pH时Fe3+、Al3+沉淀除去,加入的物质可以是MnCO3或MnO,故答案为:MnCO3或MnO ; Al(OH)3、Fe(OH)3;
(3)浓硫酸与MnO2反应也能生成Mn2+,反应的化学方程式为2H2SO4(浓)+2MnO2=2MnSO4+ 2H2O+ O2 ↑,故答案为:2H2SO4(浓)+2MnO2=2MnSO4+ 2H2O+ O2 ↑;
(4) K2MnO4在酸性、中性环境下都会歧化生成MnO4-和MnO2,为了防止歧化反应的发生,③步原料应保证KOH过量,④步溶解水应煮沸可以排除溶解的CO2,故答案为:KOH过量;排除溶解的CO2;
(5)⑤步中电解K2MnO4溶液生成KMnO4,阳极发生氧化反应,电极反应式为MnO42- -e-=MnO4-,K2MnO4溶液中含有氯化钾,电解时氯离子放电生成氯气,会污染空气,故答案为:MnO42- -e-=MnO4- ;电解时会生成氯气。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】下列各组物质中,属于同分异构体的是
A.O2和O3
B.CH2=CHCH2CH3和CH3CH=CHCH3
C. CH3CH2OH和CH3OCH3
D. CH3CH2CH3和CH3(CH2)2CH3
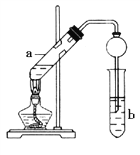
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D