题目内容
(6分)某溶液经检测只含有NH4+、Cl-、H+、OH-四种离子,
(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。
(2)若该溶液呈中性,则溶液中c(NH4+) c(Cl-)(填“>”、“<”或“=”),此时溶液中的溶质有 。
(3)若该溶液由0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合而成,则溶液中四种离子的浓度由大到小的顺序为 。
(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。
(2)若该溶液呈中性,则溶液中c(NH4+) c(Cl-)(填“>”、“<”或“=”),此时溶液中的溶质有 。
(3)若该溶液由0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合而成,则溶液中四种离子的浓度由大到小的顺序为 。
(1)NH4Cl (1分) (2)=(1分) NH4Cl和NH3·H2O(2分)
(3)c(Cl-)>c(H+)>c(NH4+)>c(OH-)(2分)
(3)c(Cl-)>c(H+)>c(NH4+)>c(OH-)(2分)
(1)根据离子的种类可知,若该溶液中只有一种溶质,则该溶质只能是NH4Cl 。
(2)根据电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以如果溶液显中性,则c(H+)=c(OH-),因此c(NH4+)=c(Cl-)。因为如果只有氯化铵,则溶液显酸性,所以要显中性,则一定还含有NH3·H2O。
(3)0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合,生成氯化铵,其中氯化氢是过量的,所以溶液显酸性,因此离子浓度大小顺序是c(Cl-)>c(H+)>c(NH4+)>c(OH-)。
(2)根据电荷守恒可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以如果溶液显中性,则c(H+)=c(OH-),因此c(NH4+)=c(Cl-)。因为如果只有氯化铵,则溶液显酸性,所以要显中性,则一定还含有NH3·H2O。
(3)0.02mol·L-1HCl与0.01mol·L-1NH3·H2O等体积混合,生成氯化铵,其中氯化氢是过量的,所以溶液显酸性,因此离子浓度大小顺序是c(Cl-)>c(H+)>c(NH4+)>c(OH-)。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
 H++A2-
H++A2- 浓度最大的是( )
浓度最大的是( )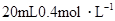 硝酸铵溶液跟
硝酸铵溶液跟 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )



 H3O++S2-
H3O++S2- CO32-+ H2O
CO32-+ H2O H2CO3 + 2OH-
H2CO3 + 2OH-