题目内容
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是白色砂状或淡黄色粉末固体,己知连二业硫酸钠在碱性条件下较稳定,易被空气氧化,不溶于甲醇,遇水迅速分解,某同学设计利用如下图所示的实验装置制备一定量的连二亚硫酸钠,装置C中的试剂为甲酸钠(HCOONa)、NaOH 的甲醇溶液,回答下列问题:
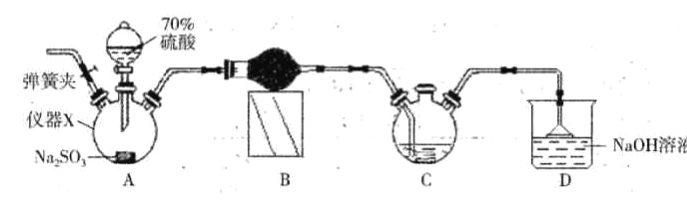
(1)仪器X的名称是_____。装置B中的球形干燥管中盛装的试剂是_______。
(2)装置D的作用是___________。实验时需要将C中温度控制在70-75℃,最好的控制方法是__________。
(3)实验开始时先打开装置A中的弹簧夹通入一段时间N2的目的是______。实验过程中装置C 中除有气体产生外,还能观察到的实验现象为____________。
(4)有同学通过仔细思考后认为,还应在C、D 之间添加一个装置,才能确保C中生成能稳定存在的连二亚硫酸钠,则该装置应具有的功能是______。为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸钠进行洗涤,洗涤的方法是_________。
(5)若实验中所用Na2SO3的质量为12.6g (硫酸是过量的),最终得到m g干燥的连二亚硫酸钠,则连二亚硫酸钠的产率为_____________。
【答案】 三颈烧瓶 无水CaCl2或P2O5 吸收过量的SO2,防止其污染空气 水浴加热 排出装置中的O2,避免其氧化连二亚硫酸钠 有(白色或淡黄色)固体生成 吸收水蒸气 在无氧环境中,向漏斗中加入甲醇至浸没晶体,待甲醇顺利流下后,重复2-3次 m/8.7×100%
【解析】(1)根据构造可判断仪器X的名称是三颈烧瓶。装置B用来干燥二氧化硫,二氧化硫是酸性氧化物,因此其中的球形干燥管中盛装的试剂是无水CaCl2或P2O5。(2)二氧化硫属于大气污染物,装置D的作用是吸收过量的SO2,防止其污染空气。实验时需要将C中温度控制在70~75℃,最好的控制方法是水浴加热。(3)连二亚硫酸钠易被空气氧化,装置中含有空气,因此实验开始时先打开装置A中的弹簧夹通入一段时间N2的目的是排出装置中的O2,避免其氧化连二亚硫酸钠。由于连二亚硫酸钠是白色砂状或淡黄色粉末固体,因此实验过程中装置C 中除有气体产生外,还能观察到的实验现象为有白色或淡黄色固体生成。(4)由于D装置中的水蒸气有可能进入到C装置中,因此还应在C、D 之间添加一个装置,才能确保C中生成能稳定存在的连二亚硫酸钠,则该装置应具有的功能是吸收水蒸气。由于产品易被氧化,不溶于甲醇,遇水迅速分解,所以洗涤的方法是在无氧环境中,向漏斗中加入甲醇至浸没晶体,待甲醇顺利流下后,重复2~3次。(5)Na2SO3的质量为12.6g,物质的量是0.1mol,根据S原子守恒可知理论上得到产品质量是0.05mol×174g/mol=8.7g,最终得到mg干燥的连二亚硫酸钠,则连二亚硫酸钠的产率为m/8.7×100%。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
