题目内容
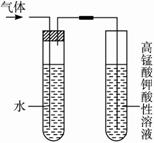
下列各种除杂质的方法中正确的是( )①用浓硫酸除去SO2气体中的水蒸气 ②将H2和O2的混合气体通过赤热的CuO,以除去氧气中的氢气 ③干燥H2S中的水蒸气,将混合气体通过盛浓硫酸的洗气瓶 ④混有乙酸的乙酸乙酯用饱和碳酸钠溶液进行除杂 ⑤用加入浓溴水的方法分离苯和苯酚的混合物 ⑥用点燃的方法除去二氧化碳中混有的少量一氧化碳⑦用热的氧化铜除去氮气中含有的少量氧气
A.①②③④ B.①④
C.②④⑥⑦ D.以上答案均不正确
答案:B

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目