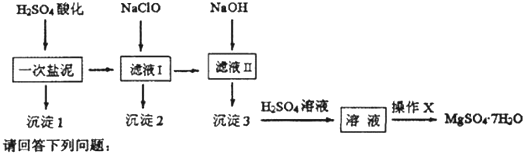
题目内容
10%的MgSO4溶液120g蒸去95.4g H2O,剩下的刚好形成MgSO4?xH2O晶体,则x值是( )
分析:根据MgSO4溶液中溶质的质量分数求出MgSO4的质量,溶液的质量减去蒸发掉的水的质量再减去硫酸镁的质量就是结晶水的质量,由两物质的质量可求出x的值.
解答:解:溶液中硫酸镁的质量为:120g×10%=12g,结晶水的质量为:120g-95.4g-12g=12.6g,
所以MgSO4?xH2O晶体中n(MgSO4)=
=0.1mol,
n(H2O)=
=0.7mol,
所以MgSO4?xH2O晶体中
=
,
即x=7,
故选:B.
所以MgSO4?xH2O晶体中n(MgSO4)=
| 12g |
| 120g/nol |
n(H2O)=
| 12.6g |
| 18g/mol |
所以MgSO4?xH2O晶体中
| 1 |
| x |
| 0.1mol |
| 0.7mol |
即x=7,
故选:B.
点评:本题考查了溶液中的有关计算,以及晶体中结晶水个数的求算,难度一般.

练习册系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: