题目内容
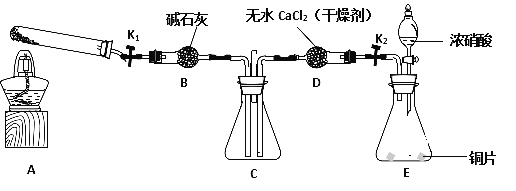
【题目】某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体成分。

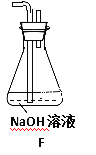
(1)填写装置的作用:B___________,C___________,G___________。
(2)证明有S02生成的实验现象是_____________________。
(3)可以证明所产生的气体中含有H2的实验现象是:E中:___________,F中:_________。如果去掉装置D,还能否根据F中的现象判断气体中有H2?_________(填能”或“不能”),原因是_________________________。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中Fe2+的方法是____________。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体。原因是___________________________;要确认有CuSO4生成,待试管冷却后,____________。写出铜与浓硫酸反应的离子方程式________________________。
【答案】 防止倒吸 检验并吸收SO2 防止空气中的H2O进入F C中酸性高锰酸钾溶液颜色变浅 黑色CuO变成红色Cu 白色无水硫酸铜粉末变成蓝色 不能 因为混合气体中可能含H2O,会干扰H2的检验 取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+ 浓硫酸中的水很少,浓硫酸有吸水性 将浓硫酸倒出,在固体中加水 Cu+2H2SO4![]() Cu2++SO2↑+2H2O+SO42-
Cu2++SO2↑+2H2O+SO42-
【解析】(1)装置B为安全瓶,防止倒吸;C中放置酸性高锰酸钾溶液,检验并除去反应产生的二氧化硫气体;G中放置碱石灰,能够防止空气中的H2O进入F 装置内,影响实验;正确答案:防止倒吸;检验并吸收SO2 ; 防止空气中的H2O进入F。
(2)S02能够与酸性高锰酸钾溶液反应,当C中酸性高锰酸钾溶液颜色变浅时,证明有S02生成;正确答案:C中酸性高锰酸钾溶液颜色变浅。
(3)装置E中试剂为氧化铜粉末,装置F中为无水硫酸铜粉末,H2能够氧化铜发生置换反应生成铜和水,因此反应现象为黑色CuO变成红色Cu , 白色无水硫酸铜粉末变成蓝色;装置D中有浓硫酸,能够吸收水蒸气,如果去掉装置D,就不能根据F中的现象判断气体中有H2,因为混合气体中可能含H2O,会干扰H2的检验;正确答案:黑色CuO变成红色Cu ; 白色无水硫酸铜粉末变成蓝色;不能;因为混合气体中可能含H2O,会干扰H2的检验 。
(4)Fe2+还原性较强,能够使酸性高锰酸钾溶液褪色,而Fe3+不能使酸性高锰酸钾溶液褪色;反应后A的溶液中含有Fe3+和Fe2+,若要检验Fe2+,方法为取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+;正确答案:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+。
(5)铜丝与浓硫酸加热反应生成硫酸铜,由于浓硫酸中的水很少,浓硫酸有吸水性,所以导致反应后出现了大量白色固体硫酸铜,而不是蓝色硫酸铜溶液;要确认有CuSO4生成,待试管冷却后,将浓硫酸倒出,把固体加入水中,变为蓝色溶液,即可得证;铜与浓硫酸反应生成硫酸铜、二氧化硫和水,离子方程式Cu+2H2SO4![]() Cu2++SO2↑+2H2O+SO42-;正确答案:浓硫酸中的水很少,浓硫酸有吸水性;将浓硫酸倒出,在固体中加水;Cu+2H2SO4
Cu2++SO2↑+2H2O+SO42-;正确答案:浓硫酸中的水很少,浓硫酸有吸水性;将浓硫酸倒出,在固体中加水;Cu+2H2SO4![]() Cu2++SO2↑+2H2O+SO42- 。
Cu2++SO2↑+2H2O+SO42- 。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案