题目内容
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
A.SO2为0.4 mol ·L-1,O2为0.2 mol ·L-1 B.SO2为0.25 mol ·L-1
C.SO2、SO3均为0.15 mol ·L-1 D.SO3为0.4 mol ·L-1
【答案】B
【解析】
试题分析:A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;B.SO2的浓度增大,说明反应向逆反应方向进行建立平衡,SO2的浓度浓度大于0.2mol/L,小于0.4mol/L即可,该题中为0.25 mol ·L-1,故B正确;C.反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误;D.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度变化为0.2mol/L,实际变化应小于该值,故D错误;故选B。本题也可以用极值法分析。

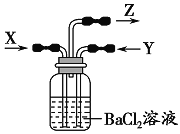
【题目】如图,将乙针筒内的物质压到甲针筒内,进行下表所列实验,对实验现象的描述错误的是
(气体在同温同压下测定)
![]()
选项 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
A | 20mLH2S | 10mLSO2 | 生成黄色固体,活塞自动向内压缩 |
B | 1g薄铜片 | 10mL12mol/L浓硝酸 | 生成棕色气体、溶液呈绿色,活塞自动外移,Cu有剩余 |
C | 30mLNO2 | 10mL水(液态) | 剩有无色气体,活塞自动向内压缩 |
D | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,最终沉淀转变为红褐色 |