题目内容
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一.2007年诺贝尔物理学奖为法国科学家阿尔贝?费尔和德国科学家彼得?格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
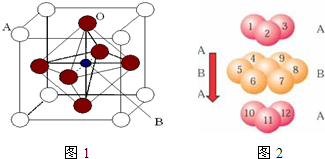
(1)用A、B、O(氧)表示此类特殊晶体的化学式
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价.导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
;(用含x的代数式表示)
(3)Mn的外围电子排布式为
(4)下列有关说法正确的是
A.镧、锰、氧分别位于周期表f、d、p区
B.CaO的熔点为2614℃,属于原子晶体
C.铬的堆积方式与钾相同,则其堆积方式如图2:
D.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强.

(1)用A、B、O(氧)表示此类特殊晶体的化学式
ABO3
ABO3
;(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价.导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
| 1-x |
| x |
| 1-x |
| x |
(3)Mn的外围电子排布式为
3d54s2
3d54s2
,在元素周期表中的位置是第四
四
周期,第ⅦB
ⅦB
族;(4)下列有关说法正确的是
AD
AD
.A.镧、锰、氧分别位于周期表f、d、p区
B.CaO的熔点为2614℃,属于原子晶体
C.铬的堆积方式与钾相同,则其堆积方式如图2:
D.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强.
分析:(1)利用均摊法计算晶体的化学式;
(2)根据化合价代数和为0的原则计算;
(3)Mn的原子序数为27,位于周期表第四周期、ⅦB族;
(4)A.根据金属在周期表中的位置判断;
B.CaO为离子晶体;
C.图中堆积方式为镁型;
D.元素的电负性越强,金属性越弱.
(2)根据化合价代数和为0的原则计算;
(3)Mn的原子序数为27,位于周期表第四周期、ⅦB族;
(4)A.根据金属在周期表中的位置判断;
B.CaO为离子晶体;
C.图中堆积方式为镁型;
D.元素的电负性越强,金属性越弱.
解答:解:(1)由图1可知,晶胞中A位于顶点,晶胞中含有A为8×
=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×
=3,则化学式为ABO3,故答案为:ABO3;
(2)设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有
解之得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
,
故答案为:
;
(3)Mn的原子序数为27,位于周期表第四周期、ⅦB族,外围电子排布为3d54s2,故答案为:3d54s2;四;ⅦB;
(4)A.由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;
B.CaO为离子晶体,故B错误;
C.图中堆积方式为镁型,故C错误;
D.元素的电负性越强,金属性越弱,故D正确.
故答案为:A D.
| 1 |
| 8 |
| 1 |
| 2 |
(2)设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有
|
解之得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
| 1-x |
| x |
故答案为:
| 1-x |
| x |
(3)Mn的原子序数为27,位于周期表第四周期、ⅦB族,外围电子排布为3d54s2,故答案为:3d54s2;四;ⅦB;
(4)A.由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;
B.CaO为离子晶体,故B错误;
C.图中堆积方式为镁型,故C错误;
D.元素的电负性越强,金属性越弱,故D正确.
故答案为:A D.
点评:本题考查较为综合,题目难度较大,注意利用均摊法计算晶胞的构成,易错点为(3),注意利用化合价代数和为零的原则计算.

练习册系列答案
相关题目





