题目内容
【题目】乙二硫醇(HSCH2CH2SH)是一种难溶于水的精细化工产品,熔点﹣41℃,沸点 144℃,具有弱酸性.实验室以硫脲和1,2﹣二溴乙烷为原料制取乙二硫醇钠的合成路线如下: 
制备装置如图1所示(加热和夹持装置已略).
回答下 列问题:
(1)取适量硫脲于三口瓶中,加入乙醇,加热溶解,再加入1,2﹣二溴乙烷.一段时间后,有烃基异硫脲盐析出.冷凝管的作用 . 使用仪器a而不用普通分液漏斗的优点是 .
(2)过滤,得到烃基异硫脲盐晶体.从滤液中回收乙醇的操作是 . (填操作名称)
(3)仍使用图1的装置,将烃基异硫脲盐晶体和适量NaOH溶液加热1.5小时,冷却,再加入稀H2SO4即可得乙二硫醇. ①加入稀H2SO4生成乙二硫醇的化学方程式为 .
②从反应后的混合物中分离乙二硫醇的操作是 . (填操作名称)
③使用该装置有一个明显缺陷,改进的措施是 .
(4)理论上,制取9.4g乙二硫醇(M=94gmol﹣1)的同时可以制得NaBrg.
(5)NaBr和Na2SO4的溶解度随温度的变化如图2所示.简述从废液中提取Na2SO4的方法: .
(6)设计实验证明乙二硫醇中含有碳元素: . 
【答案】
(1)冷凝回流;平衡漏斗与三颈瓶的压力,让溶液顺利流下
(2)蒸馏
(3)NaSCH2CH2SNa+H2SO4=HSCH2CH2SH+Na2SO4;分液;增加吸收氨气的装置
(4)20.6
(5)将盛有废液的烧杯置于冰水浴中,析出晶体后过滤,洗涤
(6)取少量的乙二硫醇充分燃烧,并将生成的气体先通入足量的酸性KMnO4溶液中,再将气体通入澄清石灰水中,石灰水变浑浊,证明乙二硫醇中含有碳元素
【解析】解:(1)冷凝管有冷凝回流的作用,从而增大反应物的转化率,增大生成物质的产率;仪器a通过支管将三颈漏斗中的蒸气进入a中,从而增大a中压强,将溶液顺利流下, 所以答案是:冷凝回流;平衡漏斗与三颈瓶的压力,让溶液顺利流下;(2)互溶的液体采用蒸馏的方法分离,二者互溶,所以采用蒸馏的方法分离,
所以答案是:蒸馏;(3)①NaSCH2CH2SNa和H2SO4反应生成HSCH2CH2SH和Na2SO4 , 反应方程式为NaSCH2CH2SNa+H2SO4=HSCH2CH2SH+Na2SO4 ,
所以答案是:NaSCH2CH2SNa+H2SO4=HSCH2CH2SH+Na2SO4;②互不相溶的液体采用分液方法分离,二者不互溶,所以采用分液方法分离,
所以答案是:分液;③氨气可以污染空气,不能直接排空,所以应该增加吸收氨气的装置,
所以答案是:增加吸收氨气的装置;(4)根据方程式知,NaSCH2CH2SNa~HSCH2CH2SH~2NaBr知,乙二硫醇(M=94gmol﹣1)和NaBr的物质的量之比为1:2,设生成NaBr的质量为xg,
HSCH2CH2SH~ | 2NaBr |
94 | 206 |
9.4g | X |
所以94:206=9.4g:x
解得x=20.6g,
所以答案是:20.6;(5)根据图知,硫酸钠溶解度随温度变化不大,而硫化钠随着温度的降低,其溶解度变化较大,所以其分离方法为:将盛有废液的烧杯置于冰水浴中,析出晶体后过滤,洗涤,
所以答案是:将盛有废液的烧杯置于冰水浴中,析出晶体后过滤,洗涤;(6)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,要用澄清石灰水吸收二氧化碳,应该先除去二氧化硫的干扰,具体方案为:取少量的乙二硫醇充分燃烧,并将生成的气体先通入足量的酸性KMnO4溶液中,再将气体通入澄清石灰水中,石灰水变浑浊,证明乙二硫醇中含有碳元素,
所以答案是:取少量的乙二硫醇充分燃烧,并将生成的气体先通入足量的酸性KMnO4溶液中,再将气体通入澄清石灰水中,石灰水变浑浊,证明乙二硫醇中含有碳元素.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(i)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250mL 溶液,
(ii)用 0.2000molL﹣1 标准盐酸滴定待测烧碱溶液,实验操作如下 A.用碱式滴定管取上述烧碱溶液10.00mL,注入锥形瓶中,加入指示剂.B.用待测定 的溶液润洗碱式滴定管.C.用蒸馏水洗干净滴定管.D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.E.检查滴定管是否漏水.F.另取锥形瓶,再重复 操作一次.G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度.
(1)①滴定操作的正确顺序是(用序号填写): .
②该滴定操作中应选用的指示剂是: .
③在G操作中如何确定终点?
(2)数据处理
实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
1 | 22.4 | 10.00 |
2 | 22.60 | 10.00 |
3 | 26.00 | 10.00 |
4 | 22.50 | 10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 , 烧碱 的纯度为
(3)下列操作,会导致实验结果偏低的是(填序号).
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗.
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
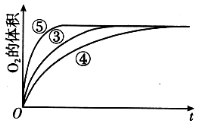
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。