题目内容
室温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是(设NA表示阿伏加德罗常数的值)
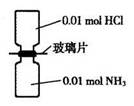

| A.气体反应物的总体积为0.448L |
| B.装置中氢元素的总质量为0.04g |
| C.生成物中含有0.01NA个分子 |
| D.生成物完全溶于永后所得溶液含有0.01 NA个NH4+ |
B
试题分析:A、n(HCl)+n(NH3)=0.02mol,缺少标准状况下,不能确定反应前两种气体的体积,错误;B、n(H)=n(HCl)+3n(NH3)=0.04mol,由n×M可知m(H)=0.04g,正确;C、氯化氢与氨气刚好完全反应生成0.01mol氯化铵,NH4Cl是离子化合物,生成物中没有分子,错误;D、NH4Cl=NH4++Cl—,铵根离子水解,所得溶液中NH4+小于0.01mol,错误。

练习册系列答案
相关题目
 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为  Na2SO4+2HCl↑
Na2SO4+2HCl↑ Na2S+2CO2↑
Na2S+2CO2↑