题目内容
将金属Mg、Fe的混合物16g投入到200mL的稀硫酸中,恰好完全反应,收集到标准状况下11.2L 氢气.下列相关说法错误的是
- A.Mg、Fe混合物总物质的量为0.5mol
- B.Mg与Fe物质的量之比为3:1
- C.生成MgSO4的质量为45g
- D.该稀硫酸物质的量浓度为0.5mol/L
分析:A、镁、铁与硫酸反应均显+2价,根据电子转移守恒计算金属的物质的量;
B、计算出金属混合物的平均摩尔质量,利用十字交叉法计算;
C、计算出镁的物质的量,利用镁原子守恒可知镁的物质的量等于硫酸镁的物质的量,在根据m=nM计算硫酸镁的质量;
D、根据H原子守恒,利用氢气的体积计算溶质硫酸的物质的量,再根据物质的量浓度定义计算.
解答:A、镁、铁与硫酸反应均显+2价,每生成1分子氢气的2个电子,根据电子转移守恒,金属的物质的量等于氢气的物质的量,所以Mg、Fe混合物总物质的量为
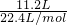 =0.5mol,故A正确;
=0.5mol,故A正确;B、由A知Mg、Fe混合物总物质的量为0.5mol,所以平均摩尔质量为
 =32g/mol,
=32g/mol,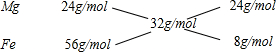
所以n(Mg):n(Fe)=24g/mol:8g/mol=3:1,故B正确;
C、由A、B可知n(Mg)=0.5mol×
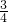 =0.375mol,根据镁原子守恒可知镁的物质的量等于硫酸镁的物质的量,所以
=0.375mol,根据镁原子守恒可知镁的物质的量等于硫酸镁的物质的量,所以m(MgSO4)=0.375mol×120g/mol=45g,故C正确;
D、氢气的物质的量为
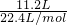 =0.5mol,根据H原子守恒可知氢气的物质的量等于溶质硫酸的物质的量,所以该稀硫酸物质的量浓度为
=0.5mol,根据H原子守恒可知氢气的物质的量等于溶质硫酸的物质的量,所以该稀硫酸物质的量浓度为 =2.5mol/L,故D错误.
=2.5mol/L,故D错误.故选:D
点评:考查金属与酸的反应混合计算,综合性较大,本题利用守恒及平均值、十字交叉法解答,注意解题方法与技巧的选择利用.

| A、铝是金属,与强碱不能发生反应 | B、Na、Mg、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | C、将混有少量SO2的二氧化碳气体通入饱和NaHCO3溶液,可达到除杂的目的 | D、过量的铜与浓硝酸反应,生成的气体只有NO2 |
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题:
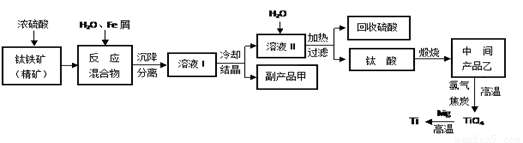
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是 (用离子方程式表示),检验副产品甲是否变质的实验方法是 。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
|
氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
|
Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:__________________________________________________________________
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应控制的反应条件是__________________________
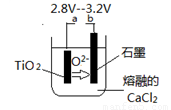
(6)在800--1000℃时电解TiO2也可制得海绵钛,装置如图所示。图中b是电源的______极,阴极的电极反应式________________。