题目内容
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g)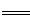 Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):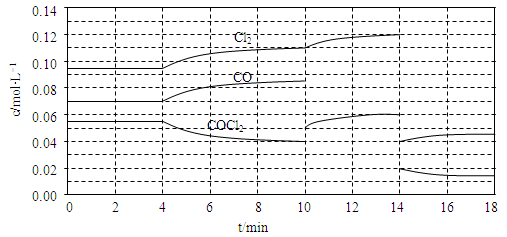
①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
(1) CHCl3+H2O2 HCl+H2O+COCl2(3分)(漏写物质0分,配平错误扣1分)
HCl+H2O+COCl2(3分)(漏写物质0分,配平错误扣1分)
(2) CH4(g)+ CO2(g)= 2CO(g)+ 2H2(g);△H=" +" 247.3kJ·mol-1(3分)
(热反应方程式2分,反应热1分,漏写物质状态扣2分,反应热正负号写错0分)
(3) ①<(2分);
②> (2分);在相同温度时,该反应的反应物浓度越高,反应速率越大(2分)(只写出浓度或者速率的变化得1分)
③0.23mol·L-1(4分)
COCl2(g)  Cl2(g) + CO(g)
Cl2(g) + CO(g)
平衡浓度(mol/L) 0.04 0.11 0.85 (1分)
K= =
= =0.23 mol·L-1
=0.23 mol·L-1
解析试题分析:(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,根据元素守恒可知产物还应有HCl和水,故方程式为CHCl3+H2O2 HCl+H2O+COCl2;(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol-1;②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol-1。(3)①第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8);②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16);③由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下K=
HCl+H2O+COCl2;(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol-1;②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ?mol-1。(3)①第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8);②在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16);③由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下K= =
= =0.23 mol·L-1。
=0.23 mol·L-1。
考点:考查热化学方程式、化学反应速率、化学平衡常数等相关知识。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 (15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) 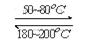 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
已知:C(s)+
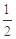 O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1C(s)+ O2(g)==CO2(g)
 H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1S(s)+O2(g)==SO2(g)
 H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1则SO2(g)+2CO(g)==S(s)+2CO2(g)
 H= kJ·mol-1。
H= kJ·mol-1。(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
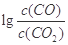 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

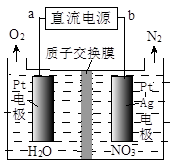
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
(15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。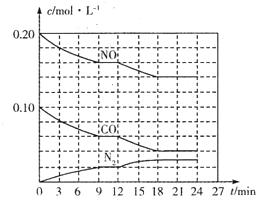
①CO在0-9min内的平均反应速率v(CO)=________mol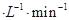 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol
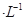 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
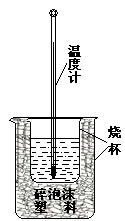
=_________。 (9分)如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答: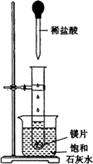
(1)实验中观察到的现象是____________________。(选填代号)
| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g) 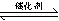 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
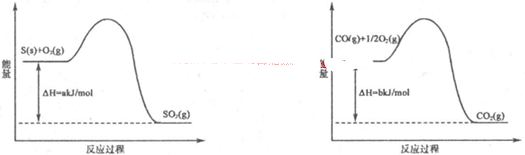
则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
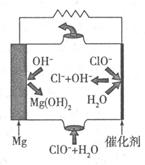
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。
天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料时的相对投资费用和能量消耗的数据。
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J·t-1 | 28×109 | 38×109 | 48×109 |
请回答下列问题。
(1)依据上表信息,你认为采用________为原料最好。
(2)请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
____________________________________________
(3)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g);ΔH=-394 kJ·mol-1①
2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1③
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式:__________________________________。
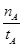 mol·L-1·min-1
mol·L-1·min-1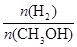 增大
增大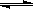 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。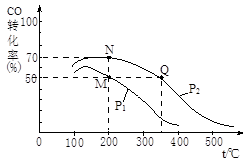
 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性