题目内容
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是 ( )
| A.原子半径的大小顺序:rX>rY>rQ>rW |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
AC
解析试题分析:Q、W、X、Y、Z是C、O、Na、Al、。A、原子核外电子层数多半径大,电子层相同核电荷数多半径小,故原子半径由大到小顺序为Na、Al、S、C、O,正确;B、氢氧化铝为两性氢氧化物与强碱氢氧化钠反应,错误;C、CS2是共价化合物,正确;D、元素非金属性越强对应氢化物越稳定,非金属性O>S,故H2O稳定性强于H2S,错误。
试题出现失误,有两个答案。
考点:考查元素周期律有关问题。

 阅读快车系列答案
阅读快车系列答案已知aAn+, bB(n+1)+, cCn-, dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
| A.原子半径:C>D>A>B |
| B.原子序数:b>a>c>d |
| C.离子半径:Cn+>D(n+)->An+>B(n+)+ |
| D.单质还原性:A>B>C>D |
下列排序正确的是( )
| A.酸性:H2CO3<C6H5OH<CH3COOH | B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<BN | D.沸点:PH3<NH3<H2O |
某矿石由前20号元素中的4种组成,其化学式为WmYnZpXq。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
| A.气态氢化物的稳定性:X<Z |
| B.含有1 mol Y的氯化物的水溶液中离子总数为4 mol(不考虑水的电离) |
| C.W位于第三周期ⅠA族,其原子半径比其他元素的都大 |
| D.2 mol W单质和1 mol Y单质投入足量的水中会产生2.5 mol气体 |
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )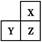
| A.原子半径:Y>Z>X |
| B.气态氢化物的热稳定性:X<Z |
| C.Y和Z的最高价氧化物对应水化物均为强酸 |
| D.若Z的最高正价为+m,则X的最高正价也一定为+m |
下列叙述中正确的是( )
| A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构 |
| D.24Mg34S晶体中电子总数与中子总数之比为1∶1 |
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是( )
| A.原子半径:Y<Q<W |
| B.ZX3可使紫色石蕊溶液变蓝 |
| C.X、Z、Q 3种元素可组成离子化合物或共价化合物 |
| D.X2Q2、Y2X6 2种分子中含有的电子数、化学键种类都相同 |
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | | Y | |
| Z | | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色。下列有关推断正确的是( )
| A.简单离子半径:Y>Z>W>Q>X |
| B.W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1∶2 |
| C.X能分别与Y、Z、W形成共价化合物 |
| D.Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应 |