题目内容
(22分)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol—1.请回答下列问题:
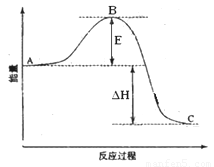
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)(2分)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= mol·L—1·min—1、
υ(SO3)= mol·L—1·min—1;
(5)(2分)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(6)甲烷燃料电池 (KOH作电解质溶液)
负极反应方程式是:
正极反应方程式是:
总反应方程式是:
(7)(2分)常温下,设pH 均为5的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1 、c2,则c1:c2= 。
(8)(2分)浓度为0.5 mol/L的盐酸与等浓度的氨水溶液反应,使溶液呈中性,则混合前体积V酸________V碱(填“大于”、“小于”或“等于”)
(9)(2分)取10 mL溶液0.5 mol/L的盐酸,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
(22分)(1)反应物能量 生成物能量 无 降低 因为催化剂改变了反应的历程使活化能E降低 (2)(2分)—198
(3) (2分)SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5
(4)(2分)0.025 0.05
(5) (2分)S(s)+O2(g) =2SO2(g) △H1=—296 KJ·mol—1 ,
SO2(g)+1/2O2(g)  SO3(g)
△H2=—99 KJ·mol—1
SO3(g)
△H2=—99 KJ·mol—1
3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=—1185 KJ·mol—1
(6)负极:CH4+10OH- -8e-=CO32-+7H2O 正极:O2+2H2O+4e-=4OH-
总反应:CH4+2 O2+2OH-=CO32-+3H2O
(7)(2分)1:104 (8)(2分)小于(9)(2分)10-12
【解析】

 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
 CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
 (正)
(正) (逆) b.
(逆) b. 2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。