题目内容
下列反应的离子方程式正确的是
A. 氧化亚铁溶于稀硝酸中:FeO+2H+=Fe2++H2O
B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C. 氧化铁溶于氢碘酸:Fe2O3 + 6H+=2Fe3+ + 3H2O
D. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示。下列说法中正确的是( )
元素 | 甲 | 乙 | 丙 | 丁 |
化合价 | -2 | -3 | -4 | -2 |
A. 元素非金属性:甲<乙 B. 含氧酸的酸性:乙<丁
C. 氢化物的沸点:甲>丁 D. 丙所形成的单质可能互为同位素
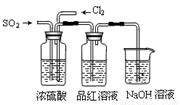
某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如下装置:

(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是__________。
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:_____________________。
(3)装置C的作用是_____________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
 通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):_____________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?____________________。
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)_____________。
②你认为减少酸雨产生的途径可采用的措施是________。
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图第一个洗气瓶中盛放的液体为_____________。



 2HI(g)△H<0。相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。下列说法错误的是
2HI(g)△H<0。相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。下列说法错误的是