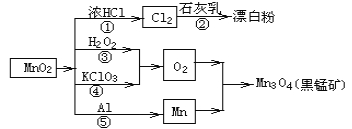
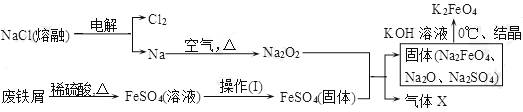
题目内容
【题目】已知酸性高锰酸钾溶液可以将FeSO4 氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是

A.方程式中的X为2MnSO4
B.氧化性:KMnO4>Fe3+>I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol
D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2
【答案】C
【解析】
试题分析:A、根据元素守恒可知,方程式中的X为2MnSO4,正确;B、根据氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,可得氧化性:KMnO4>Fe3+>I2,正确;D、根据氧化性顺序,AB段是高锰酸钾和碘化钾溶液反应,BC段为Fe3+氧化I,离子方程式为:2Fe3++2I-===2Fe2++I2,正确;C、AB段反应的I为0.5mol,根据2MnO4+10I+16H+=2Mn2++5I2+8H2O可得消耗的KMnO4为0.1mol,BC段反应的I为1.25mol—0.5mol=0.75mol,则消耗的Fe3+为0.75mol,根据2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,消耗KMnO4为0.25mol,所以开始加入的高锰酸钾的物质的量为0.35 mol,错误。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目