题目内容
①第一份溶液中加入酚酞试液,滴加O.250mol/L NaOH溶液至20.00mL时,溶液由无色变为浅红色.
②第二份溶液中滴加O.100mol/L的酸性高锰酸钾溶液至16.00mL时,溶液颜色由无色变为紫红色.
原试样中H2C2O4?2H2O的质量分数为( )
| 250 |
| 25 |
| 5 |
| 2 |
根据①中的中和滴定可得:2x+y=0.25×0.02×
| 250 |
| 25 |
②中为氧化还原反应滴定,由方程式可知,n(H2C2O4?2H2O)+n(KHC2O4)=
| 5 |
| 2 |
即x+y=0.1×0.016×2.5×
| 250 |
| 25 |
联立方程,解得x=0.01,y=0.03mol,
所以原混合物中H2C2O4?2H2O的质量分数为
| 0.01mol×126g/mol |
| 6g |
故选D.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
| H2C204 | KHC204 | K2C204 |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+=10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
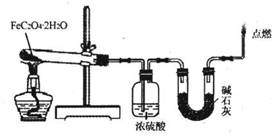
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)

草酸(H2C204)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C204、KHC204、K2C204溶液的pH如下表所示。 。.
|
|
H2C204 |
KHC204 |
K2C204 |
|
pH |
2.0 |
3.1 |
8.1 、 |
(1)在其它条件不变时,下列措施能使KHC204溶液中c(K+):c(HC204-)接近1:1的是_________(填字母)。
A.加入适量的H2C204 B.加入适量的KHC204
C.加入适量的Na2C204 D.升高溶液的温度
(2)取一定质量H2C204·2H20和KHC204的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2042-+2Mn04-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C204·2H20和KHC204的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC204·2H20在隔绝空气条件下受热分解的产物。当36.0g FeC204·2H20充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC204·2H20的相对分子质量为180;设反应产生的气体被充分吸收)